
已知Cr(OH)
3在碱性较强的溶液中将生成[Cr(OH)
4]
-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法:
★还原法:在酸性介质中用FeSO
4等将+6价铬还原成+3价铬.
具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr
2与FeSO
4溶液在酸性条件下反应的离子方程式
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
.
(2)还原+6价铬还可选用以下的
BD
BD
试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO
4,再调节pH,使Fe
3+和Cr
3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为
CD
CD
(填序号).
A.Na
2O
2 B.Ba(OH)
2 C.Ca(OH)
2 D.NaOH
此时调节溶液的pH在
B
B
(填序号)范围最佳.
A.3~4 B.6~8 C.10~11 D.12~14
★电解法:将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe
2+和Cr
2发生反应,生成的Fe
3+和Cr
3+在阴极区与OH
-结合生成Fe(OH)
3和Cr(OH)
3沉淀除去.
(4)写出阴极的电极反应式
2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-
2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-
.
(5)电解法中加入氯化钠的作用是
增强溶液导电性或盐析
增强溶液导电性或盐析
.
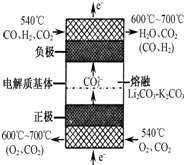
(6)若外接电源为熔融碳酸盐燃料电池,其工作原理示意图如图,则熔融碳酸盐燃料电池的正极反应可表示为
O2+4e-+2CO2═2CO32-
O2+4e-+2CO2═2CO32-
.

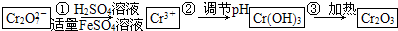
 已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法:
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法: