
题目列表(包括答案和解析)
| c[Co(H2O)62+]c4(Cl-) |
| c(CoCl2-) |
| c[Co(H2O)62+]c4(Cl-) |
| c(CoCl2-) |

| ||
| ||
| 反应现象 | 两支试管中紫色KMnO4溶液均褪色,乙试管中溶液褪色较快 两支试管中紫色KMnO4溶液均褪色,乙试管中溶液褪色较快 |
| 实验结论 | MnSO4(Mn2+)是此反应的催化剂,加入催化剂可以使化学反应速率加快 MnSO4(Mn2+)是此反应的催化剂,加入催化剂可以使化学反应速率加快 |
| 试管中发生反应的离子方程式 | 2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O 2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O |



| ||
| ||
2- |
2- 3 |
2- 3 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | ----- |
| 步骤2: | |
| 步骤3: |
⑴近年来我国出现大范围雾霾天气,许多城市发布PM2.5重度污染警报。
①下列行为不会增加城市大气中PM2.5浓度的是 (填字母)。
a.燃放烟花爆竹 b.为城市主干道洒水保洁 c.露天焚烧落叶
②雾霾会刺激呼吸道,使人易患流行性感冒。感冒发烧病人可服用 药品进行治疗(填字母)。
a.麻黄碱 b.抗酸药 c.阿司匹林
③多食富含维生素C的蔬菜水果可增强人的免疫力。维生素C的结构简式是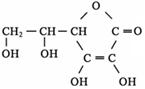 ,它的分子式是 。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性。
,它的分子式是 。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性。
⑵今年1月12日,我国3名潜水员圆满完成首次300米饱和潜水作业,实现“下五洋捉鳖”的壮举。
①潜水员乘坐的潜水钟以钢铁为主要制造材料。钢铁容易在潮湿空气中发生电化学腐蚀,其负极的电极反应式是 。
②潜水员需要均衡的膳食结构。糖类、油脂、蛋白质都能为人体提供能量。某品牌高钙梳打的配料标签如图所示。在所列配料中,富含糖类的是 ,植物油在体内水解最终产物是高级脂肪酸和 。碳酸氢钠、碳酸钙可调节人体内的过多的胃酸,写出碳酸钙与胃酸反应的离子方程式为 。
③运载潜水钟的母船会产生大量废水和垃圾。科学实验的含汞离子废水 需要处理后再排放,可加入适量的硫化钠溶液,使汞离子变成 (填化学式)沉淀而除去;
⑶著名物理化学家张存浩院士获得2013年国家最高科学技术奖,他在氟化氢(氘)激光器和水煤气合成液体燃料研究等方面做出了重要贡献。
①氟化氢(HF)的水溶液能雕刻玻璃。制备普通玻璃的主要原料有SiO2、CaCO3、 (填化学式)。
②水煤气的主要成分是CO和H2,在40MPa、380℃、锌铬氧化物做催化剂的条件下,用CO和H2合成液体燃料CH3OH,该反应的化学方程式为 。
⑷材料的不断发展可以促进社会进步。
① “玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中
使用了镁铝合金,选用镁铝合金的优点是 (任答一点)。
②碳化硅硬度很大,它属于 (填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
③随便丢弃用过的聚乙烯塑料膜会造成白色污染,写出由乙烯在催化剂作用下制备聚乙烯的化学方程式 ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com