
题目列表(包括答案和解析)
10分)(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,正确的操作是 __________。纯碱溶液呈碱性的原因(用离子方程式表式)是__________,你认为该溶液pH的范围一定介于__________之间。
(2)为探究纯碱溶液呈碱性是由![]() 引起的,请设计一个简单的实验方案。
引起的,请设计一个简单的实验方案。
(10分))
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,离子反应方程式为 。
(2)常温下,向20 mL 1.0  的
的 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的
 溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈? ?(填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为
。
溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈? ?(填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为
。

(3)碘酸钾是食盐中的添加剂。检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂最好是 。定量测定产品中KIO3的含量时,可先用水溶解再通入SO2,然后用Na2S2O3标准溶液滴定析出的碘,通SO2的离子方程式为: 。
(10分))
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,离子反应方程式为 。
(2)常温下,向20 mL 1.0  的
的 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的 溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈? ?(填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为 。
溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈? ?(填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为 。
(3)碘酸钾是食盐中的添加剂。检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂最好是 。定量测定产品中KIO3的含量时,可先用水溶解再通入SO2,然后用Na2S2O3标准溶液滴定析出的碘,通SO2的离子方程式为: 。
冶炼金属常用以下几种方法:①以C、CO或H2做还原剂 ②以活泼金属Na、Mg等还原 ③利用铝热反应原理还原 ④电解法 ⑤热分解法。下列金属各采用哪种方法还原最佳。(用序号填写下列空白。)(共10分)
(1)Fe、Zn、Cu等中等活泼金属 。
(2)Na、Mg、Al等活泼或较活泼金属 。
(3)Hg、Ag等不活泼金属 。
(4)V、Cr、Mn、W等高熔点金属 。
(5)K、Rb、Cs、Ti等金属通常还原方法是 。
(10分) 将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体
积V变化如右图所示。当V1=140mL时,则金属粉末中
n(Mg)= mol,V2= mL。
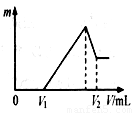
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴
入NaOH溶液的体积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入480 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:
(4)若滴加NaOH溶液致V2ml时,停止滴加NaOH溶液,开始往溶液中通入足量CO2,请写出发生反应的离子方程式——————————————————————-————。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com