
题目列表(包括答案和解析)
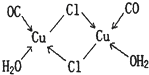
铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)基态铬原子的价电子排布式为 。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为:K2Cr2O2+3CCl4
2KC+2CrO2Cl2+3COCl2↑。
①上述反应式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于 晶体。
③COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO FeO(填”<”、 “=”或 “>”)。
(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O],其结构如图。下列说法不正确的是 (填标号)。
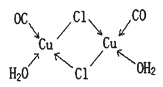
A.该复合物中存在化学健类型只有离子键、配位键
B.该复合物中Cl原子的杂化类型为sp3
C.该复合物中只有CO和H2O作为配位体
D.CO与N2的价电子总数相同,其结构为C=O
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
1 1 |
2 1 |
3 1 |
| A、①④⑥⑧ | B、②③④⑧ |
| C、①②⑥⑦ | D、②③⑥⑦⑨ |
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 ,写出与CO互为等电子体的一种离子的化学式为 。
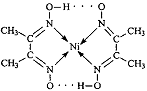 (2)右图配合物分子内的作用力除共价键外,还存在的两种作用 力是 (填编号)。
(2)右图配合物分子内的作用力除共价键外,还存在的两种作用 力是 (填编号)。
A.氢键 B.离子键 C. 范德华力 D.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。
如:①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
(4)Mn、Fe和Ni一样均为第四周期过渡元素,两元素的部分电离能数据如下表。
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
据此分析Mn2+比Fe2+ (填 “更易” 或“更难 ”)再失去-个电子,从微粒结构的角度简述其原因是 。
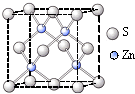
(5)NiO的晶体结构类型与氯化钠的相同,NiO晶胞中与Ni最近的Ni的数目为 个。
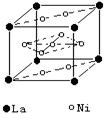 (6)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一镍原子,其他镍原子都在晶胞面上。该晶体的化学式是______。
(6)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一镍原子,其他镍原子都在晶胞面上。该晶体的化学式是______。

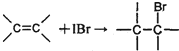
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com