
题目列表(包括答案和解析)
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: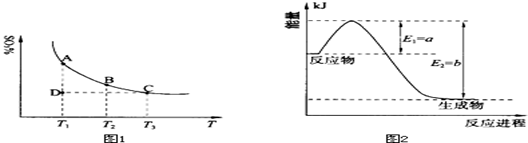
①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正 v逆(填“>”、“<”或“=”,下同)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: .
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2?L-2,Ksp[AgI]=1.5×10-16mol2?L-2),在25℃下,向0.1L0.002mol?L-1的NaCl溶液中逐滴加入0.1L0.002mol?L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1L0.002mol?L-1的NaI 溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
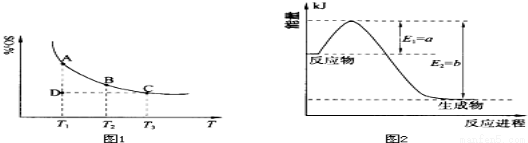
①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正 v逆(填“>”、“<”或“=”,下同)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: .
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2?L-2,Ksp[AgI]=1.5×10-16mol2?L-2),在25℃下,向0.1L0.002mol?L-1的NaCl溶液中逐滴加入0.1L0.002mol?L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1L0.002mol?L-1的NaI 溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”); Ni(CO)4(g) 该反应的ΔH_________0 (选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH_________0 (选填“>”或“=”或“<”)。 Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总 物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。求上述酸化后所得溶 液的pH_________。
Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总 物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。求上述酸化后所得溶 液的pH_________。 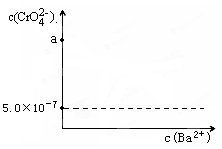
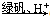 Cr3+
Cr3+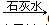 Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10-3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278)__________Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10-3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278)__________Kg(保留两位小数)。 (14分)
Ⅰ.在一定条件下的下列可逆反应达到平衡时,试填出:xA+y Bz C
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是________;
(2)若C是气体,并且x+y=z,在加压时化学平衡可发生移动,则平衡必定是向_____方向移动;
(3)已知B、C是气体,现增加A物质的量,平衡不移动,说明A是______(填状态);
(4)如加热后,C的百分含量减小,则正反应是________热反应。
Ⅱ.如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,V(A)=V(B)= a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g)2Z(g)+W(g);ΔH<0。达到平衡时,V(A)= 1.2a L。
试回答:
(1)A中X的转化率α(A)___________________________。
(2)A、B中X的转化率的关系:α(A) ___________α(B)。(填“<”“>”或“=”)
(3)打开K,一段时间又达到平衡,A的体积为___________L。(连通管中气体体积不计)
(物理参考答案)
一.选择题(每小题6分,共48)
14.B 15.CD 16.AC 17.ABC 18.BD 19.B 20.BCD 21.B
22.(19分)Ⅰ(10分) (1)① 辉度(或写为¤) ② 聚焦(或写为○)
③垂直位移(或写为↑↓) 、水平位移(或写为.files\image114.jpg) ) (2)C
) (2)C
Ⅱ(9分)①在白纸上另画一条与y轴正方向的夹角较小的直线OA,把大头针P1、P2竖直地插在所画的直线上,直到在y<0的区域内透过玻璃砖能看到P1、P2的像.
②插上P3后,P3刚好能挡住P1、P2的像.
③.files\image116.gif)
23.(16分)由图可得 (1)θ=π/2时,根据v02=2gs
代入数据得v0=
(2) θ=0时 a=μg v02=2μgs 代入数据得μ=0.5 -------------- 5分
(3)斜面倾角为θ时,物体的加速度
.files\image118.gif) -------1分
-------1分
.files\image120.gif) ----------------1分
----------------1分
令.files\image122.gif) 则
则.files\image124.gif) -------------------2分
-------------------2分
所以物体沿斜面上升的最大位移的最小值.files\image126.gif) m----------2分
m----------2分
24.(18分)解:(1)粒子在正方形区域abcd中做类平抛运动。在RO方向做匀速直线运动,.files\image128.gif) ;在ab方向做初速度为0的匀加速直线运动。
;在ab方向做初速度为0的匀加速直线运动。
运动时间 .files\image130.gif) ------------------------1分
------------------------1分
.files\image132.gif) ------------------------2分
------------------------2分
粒子射出dc边界时
vy=at1=1.5×
粒子的运动速度为v=.files\image134.gif) =2.5×
=2.5×
粒子的速度偏向角的正切为tanq=vy/ v0=0.75, q=37° ------------------------2分
粒子飞出电场后在界面cd、PS间的无电场区域做匀速直线运动,所以粒子穿过界面PS时的速度大小为v=2.5×
(2)粒子由界面ab运动到界面PS的过程中竖直方向上的位移
.files\image136.gif) ------------------------2分
------------------------2分
由题意,粒子穿过界面PS时速度方向和库仑力方向垂直,库仑力提供向心力。
所以点电荷Q带负电,------------------------1分
粒子做圆周运动的半径为R=y/cosq=
由 =m 得
Q== C=1.04×10-
25.(19分)设时刻t两金属杆甲、乙的速度分别为.files\image138.gif) 和
和.files\image140.gif) ,
,
回路中的感应电动势.files\image142.gif) ------------------------4分
------------------------4分
回路中的电流 .files\image144.gif) ------------------------2分
------------------------2分
杆甲的运动方程.files\image146.gif) ------------------------2分
------------------------2分
由于作用于杆甲和杆乙的安培力总是大小相等,方向相反,所以两杆的动量.files\image148.gif) 时为0)等于外力F的冲量
时为0)等于外力F的冲量 .files\image150.gif) ------------------------5分
------------------------5分
联立以上各式解得.files\image152.gif) ------------------------2分
------------------------2分
.files\image154.gif) ------------------------2分
------------------------2分
代入数据得.files\image156.gif) ------------------------2分
------------------------2分
(化学参考答案)
题号
6
7
8
9
10
11
12
13
答案
A
B
C
B
A
D
A
B
26.(15分) (1)
Na (2分) (2)H+、HO.files\image158.gif) 、O
、O.files\image160.gif) 、OH ? 、H2O2、H2O (3分)
、OH ? 、H2O2、H2O (3分)
(3)(略) 离子键、共价键 (共4分)(4)H+ +
HSO.files\image162.gif)
SO2↑+
H2O (3分)
(5)负极;O2+2H2O+4e-=4OH-(共3分)
27.(共17分) (1) 羟基、羧基(2分)
(2) (6分)
.files\image164.jpg)
(3)加成反应,酯化(取代)反应 (2分)
(4)3 (2分)
(5) 4 (2分)
(6)(3分)
.files\image166.jpg)
28.(共19分)(I)AB (2分)
(Ⅱ)⑴ 生成的NO被试管里的氧气氧化为NO2 (2分)
⑵ 除去A试管中的氧气(2分);
CuO+2HNO3=Cu(NO3)2+H2O (3分)
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O(3分)
NaOH溶液(2分) ,吸收实验中的尾气 (2分)
⑶ BCE (3分)
29.(共9分)(1)90.00%
(6分)
(2)SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ/mol (3分)
(生物参考答案)
1、B 2、D 3、B 4、A 5、C
30(一)(10分)(1)阴雨或低温(2分)(2)如图甲所示 (2分)(3)B线 (2分)
(4)A线 (2分)(5)葡萄糖被氧化分解、合成淀粉或转化为其它有机物(2分)
.files\image167.gif) |
(二)(12分)
(1)取4个大烧杯,编号为A、B、C、D。(2分)
(2)将水质清澈的池塘水适量且等量加入4个烧杯中。A杯加入适量的适宜浓度的含N溶液;B杯加入等量的适宜浓度的含P溶液;C杯加入等量的含N和P溶液的混合液;D杯加入等量的蒸馏水。用吸管向4个烧杯加入等量的少量衣藻培养液。(2分)
(3)将4个装置放在有光的适宜条件下。(2分)
(4)7天(或一段时间后)观察烧杯中水体的颜色变化(2分)
预期现象:
C杯内水体呈现碧绿色,其余杯内颜色浅而且基本相同。(2分)
结论:
N、P元素含量只有同时偏高时,才会使水体出现“水华”现象。(2分)
31(20分)
(1)黄色(2分) F2(2分) 3/32(2分)
(2)白种皮甜玉米(2分)和白种皮非甜玉米(2分) 1/2(2分)
(3)控制有关酶的合成来控制代谢(2分)
(4)
①全长成高茎,说明生长素类似物引起的变异能够遗传(2分)
②全长成矮茎,说明生长素类似物引起的变异不能够遗传(2分)
③若部分长成高茎,部分长成矮茎,说明生长素类似物引起的变异能够遗传(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com