
题目列表(包括答案和解析)
 化学是一门以实验为基础的自然科学.
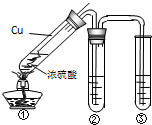
化学是一门以实验为基础的自然科学. 如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.
如图所示,中学化学实验室采用该装置用于制备乙酸乙酯. CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O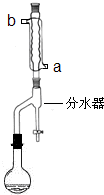 (2012?江苏一模)在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
(2012?江苏一模)在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.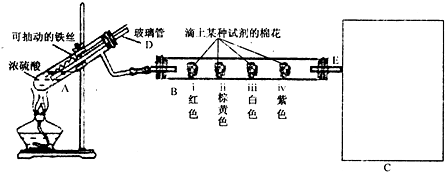


| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释或结论 |
| i | 品红溶液 品红溶液 |
棉球变为白色,微热后又恢复红色 | |
| ii | FeCl3溶液 FeCl3溶液 |
棉球变为浅绿色 | 离子方程式: SO2+2Fe3++2H2O=2Fe3++SO42ˉ+4H+ SO2+2Fe3++2H2O=2Fe3++SO42ˉ+4H+ 结论: SO2有还原性 SO2有还原性 |
| iii | Na2S溶液 | 棉球变为浅黄色 | 解释:浅黄色物质是 S S 结论: SO2有氧化性 SO2有氧化性 |
| iv | 石蕊试液 石蕊试液 |
棉球变为红色 | 化学方程式: SO2+H2O?H2SO3 SO2+H2O?H2SO3 结论:该气体属于酸性氧化物 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com