
题目列表(包括答案和解析)
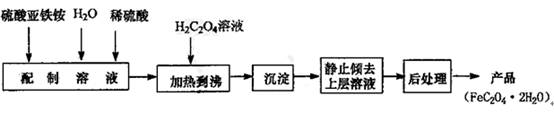
(14分) 草酸亚铁用作分析试剂及显影剂等,其制备流程如下:

⑴配制(NH4)2Fe(SO4)2 6H2O溶液时,需加少量稀硫酸,目的是
。
6H2O溶液时,需加少量稀硫酸,目的是
。
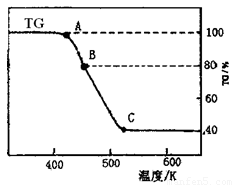
⑵将制得的产品在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。
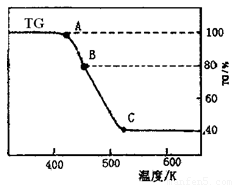
①则C处时残留物的化学式为 。
②有研究学者在实验过程中用气相色谱还检出H2,最终产 物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实: 。
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)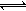 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
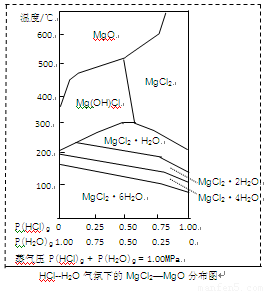
(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。结合右图请回答下列问题:
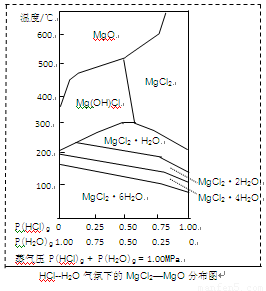
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;若要得到无水MgCl2须采取的措施是 。
(14分) 草酸亚铁用作分析试剂及显影剂等,其制备流程如下:
⑴配制(NH4)2Fe(SO4)2 6H2O溶液时,需加少量稀硫酸,目的是
。
6H2O溶液时,需加少量稀硫酸,目的是
。
⑵将制得的产品在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。
①则C处时残留物的化学式为 。
②有研究学者在实验过程中用气相色谱还检出H2,最终产 物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实: 。
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)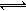 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。结合右图请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;若要得到无水MgCl2须采取的措施是 。
(14分)
Ⅰ.(每空1分) 已知某工业废水中含有大量的CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其他物质。

(1)步骤1需用到的玻璃仪器除烧杯外有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,固体残渣的成分是(填化学式) 。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是 。
Ⅱ.((2)为1分,其余每空2分)某溶液中含有Na+、SO、SO、CO、Cl-、Br-中的若干种,依次进行下列实验,观察到的现象记录如下:①加入盐酸,有无色气体生成;②向原溶液中滴加氯水,无气体产生,再加CCl4振荡,静置,CCl4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,过滤;④在滤液中加AgNO3和HNO3的混合液,有白色沉淀产生.试回答:(提示:氯气会氧化SO为SO)
(1)原溶液中肯定存在的离子是 ,肯定没有的离子是 ;
(2)若步骤③改用BaCl2和盐酸的混合溶液,对判断(1)结论有无影响 ;
(3)步骤②中发生反应的离子方程式为 、 .
(14分)高锰酸钾俗称PP粉,为强氧化剂,遇到有机物就放出活性氧。这种氧有杀灭细菌的作用,且杀菌能力极强。某学生欲在实验室配制1 L 0.06 mol/L KMnO4稀溶液,用来清洗伤口。
(1)实验过程中需用托盘天平称取KMnO4晶体的质量为__________g。
(2)其操作步骤如下图所示,则右图所示操作应在下图中__________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
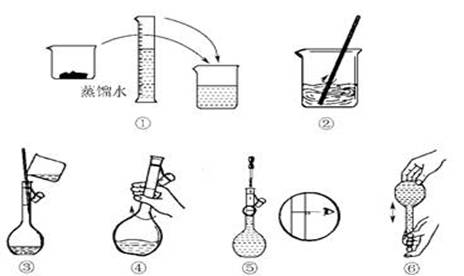
(3) 配制过程中需要用到的仪器有:托盘天平、药匙、烧杯、 、 、
(4)若该同学在配制溶液时,进行了如下操作,其中使所配溶液浓度偏低的操作
有_______________(填选项字母)。
A.称量KMnO4晶体时,指针偏向右边
B.将KMnO4晶体放在烧杯中溶解,冷却后,转移至含有少量蒸馏水的容量瓶中
C.定容时,仰视刻度线
D.振荡摇匀后,发现溶液液面低于刻度线,再滴加少量蒸馏水至刻度线处
(14分)欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数。资料表明:①反应中除生成NO2气体外还有少量的NO生成;②常温下N02与N2O4混合存在,在低于0℃时几乎只有无色N2O4液体或晶体存在。为完成测定并验证有NO生成,有人设计下图实验装置。
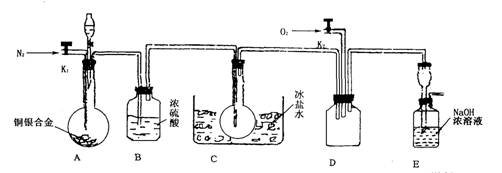
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是_____________________________________________________________。
(2)装置B瓶的作用是__________________________________________________。
(3)A中反应停止后,打开D中的活塞K2并通人氧气,若反应中确有NO产生,则D中应出现的现象是________________;实验发现,通人氧气温度的高低对实验现象有较大影响,则为了便于观察应通人_______________(填“冷”或“热”)的氧气。
(4)为了减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是__________________________________________________________。
(5)实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5mol·L-1。实验后:A中溶液体积为40mL,H+浓度为1.0mol·L-1。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为______________;
②若已测出反应后E装置的生成物含氮元素的质量,则为确定合金中铜的质量分数,还需要测定的数据是__________。
(6)实验中只测定铜的质量分数,不验证NO的产生,则在铜银合金与硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com