
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||||
某兴趣小组的同学们共同设计了下图所示的实验装置,此装置既可用于制取气体,又可用于验证物质的某些性质.
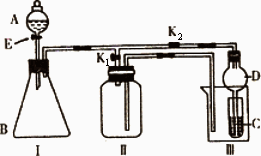
(1)若利用该装置制取并收集H2或NH3,在I中加入药品后应该进行的操作是________;若要制取并收集O2或NO,更换Ⅰ中药品后,不更换仪器,只需要作简单改进,即可完成实验,其改进的方法是________.
(2)打开K2,关闭K1.
①利用该装置进行实验,可以证明以下物质的酸性强弱顺序为:HCl>H2CO3>H2SiO3.
有同学认为:在A中加________,B中加CaCO3,C中加________(均填写物质的化学式).观察到________的现象,即可证明.但有的同学认为此实验证明酸性H2CO3>H2SiO3时有缺陷,你认为缺陷是________.
②利用该装置可以制取Cl2,并在70℃时与NaOH溶液反应生成NaClO和NaClO3.
实验方案是:在A中加浓盐酸,B中加高锰酸钾,C中加氢氧化钠溶液,烧杯中加________.
待C中溶液恰好反应后,向其中加入过量KI溶液,加入醋酸调节溶液的酸性,此时只有NaClO被还原,然后用一定浓度的Na2S2O3溶液滴定;继续向其中加入盐酸,调节溶液的酸性,此时NaClO3被还原,再用同浓度的Na2S2O3溶液滴定.(![]()
![]() )实验结果记录如下:
)实验结果记录如下:

试通过表中数据计算C溶液中生成的ClO-和![]() 的物质的量之比________.
的物质的量之比________.
(4分)铁的氧化物有多种用途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式 。某赤铁矿除了含Fe2O3之处,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应过滤,即可得到较纯净的Fe2O3。发生反应的离子方程式是 。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量 稀盐酸,然后滴加KSCN溶液,若出现血红色,证明含有Fe2O3。否则,不含有Fe2O3。
你认为该方案合理吗?为什么? 。
(3)合成氨工业中所用的α―Fe催化剂的主要成分是FeO、Fe2O3。已知当催化剂中Fe2+和Fe3+的物质的量之比为1:2时,其催化活性最高。某化学小组试图以Fe2O3为原料制备该催化剂,方法之一是向其中加入炭粉高温反应:
![]()
实验教师提供了12g炭粉。请你计算,若要制取这种活性最高的催化剂,加入的Fe2O3的质量为 g。 该小组设计了多个实验方案来测定所得产品是否符合要求。其中一个实验方案是用氢气还原加热的混合物,测定铁的质量分数。在用锌跟稀硫酸反应制取氢气时,该小组的同学向稀硫酸中加入少量硫酸铜溶液,目的是 。当混合物中铁的质量分数为 (用化简的分数表示)时,该产品合格。
某兴趣小组的同学们共同设计了下图所示的实验装置,此装置即可用于制取气体,又可用于验证物质的某些性质。
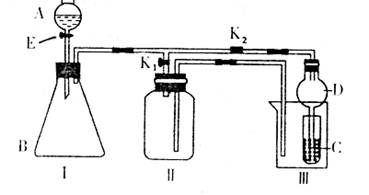
(1)若利用该装置制取并收集H2或NH3,在I中加入药品后应该进行的操作是
;若要制取并收集O2或NO,更换I中药品后,不更换仪器,只需要作简单改进,即可完成实验,其改进的方法是
。
(2)打开K2,关闭K1。
①利用该装置进行实验,可以证明以下物质的酸性强弱顺序为:HC1>H2CO3>H2SiO3。有同学认为:在A中加 ,B中加CaCO3,C中加 (均填写物质的化学式)。观察到 的现象,即可证明。但有的同学认为此实验在证明酸性H2CO3>H2SiO3时有缺陷,你认为缺陷是 。
②利用该装置可以制取C12,并在70℃时与NaOH溶液反应生成NaC1O和NaC1O3。实验方案是:在A中加浓盐酸,B中加高锰酸钾,C中加氢氧化钠溶液,烧杯中加 。待C中溶液恰好反应后,向其中加入过量KI溶液,加入醋酸调节溶液的酸性,此时只有NaC1O被还原,然后用一定浓度的Na2S2O3溶液滴定;继续向其中加入盐酸,调节溶液的酸性,此时NaC1O3被还原,再用同浓度的Na2S2O3溶液滴定。(I2+2S2O32―=S4O62―+2I―)实验结果记录如下:
| 将KI转化为I2 | 滴定I2,消耗Na2S2O3溶液的体积 |
| KI | 5.00mL |
| KI | 30.00mL |
通过表中数据计算C溶液中生成C1O―和C1O3―的物质的量之比 。
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).

请按要求填空:
(1)利用B装置可制取的气体有____________(写出两种即可).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
①若在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由________________
________________________________________________________________________.
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛放的试剂、实验现象及结论)__________________________________________
________________________________________________________________________.
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验.
①B中发生反应的化学方程式为______________________________________
________________________________________________________________________.
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是________________.
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的氧气,直到试管全部充满水,则所得溶液中溶质的物质的量浓度是________(气体按标准状况计算).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com