
题目列表(包括答案和解析)
工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g) 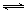 CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。

请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
|
实验组 |
T/℃ |
起始浓度/mol•L-1 |
等质量催化剂的 比表面积/m2•g-1 |
|
|
CO |
H2 |
|||
|
① |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
② |
280 |
1.20×10-3 |
5.80×10-3 |
124 |
|
③ |
350 |
|
|
124 |
其中设计实验组①和②的目的是______。
(3)“图2”所揭示的规律是:在p1压强达平衡时______;并请画出在p2压强下(p2 > p1)的曲线。
(4)在碱性条件下可将合成甲醇的反应设计成原电池,则负极的电极反应式为______。
工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g) CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。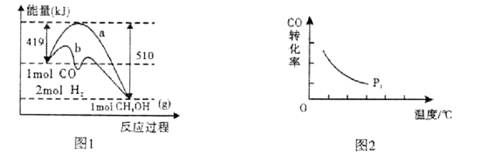
请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
| 实验组 | T/℃ | 起始浓度/mol?L-1 | 等质量催化剂的 比表面积/m2?g-1 | |
| CO | H2 | |||
| ① | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| ② | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| ③ | 350 | | | 124 |
(14分)(1)二氧化硫的催化氧化的过程如图所示,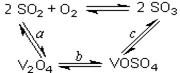
其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 温度/℃ | 0.1[ | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。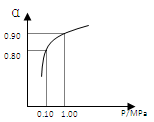
(14分)(1)二氧化硫的催化氧化的过程如图所示,
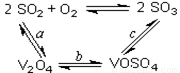
其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
|
压强/MPa 温度/℃ |
0.1[ |
0.5 |
1 |
10 |
|
400 |
99.2% |
99.6% |
99.7% |
99.9% |
|
500 |
93.5% |
96.9% |
97.8% |
99.3% |
|
600 |
73.7% |
85.8% |
89.5% |
96.4% |
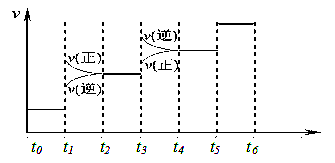
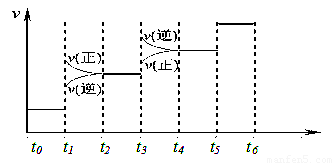
当合成SO3的反应达到平衡后,改变某一外界条件(不改变SO2、O2和SO3的量),反应速率与时间的关系如图所示。图中t1 时引起平衡移动的条件可能是 其中表示平衡混合物中SO3的含量最高的一段时间是 。
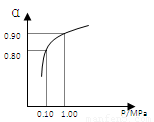
(3)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。将2.0
mol SO2和1.0
mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10
M Pa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K=
。
2SO2+O2 在550 ℃时的平衡常数K=
。
反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)SO3溶于水得到硫酸。在25°C下,将x mol·L-1的氨水与y mol·L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+) 2 c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com