
题目列表(包括答案和解析)
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) |
0.74 | 1.02 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) |
0.74 | 1.02 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最 低化合价 |
+6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |




| ||
| ||
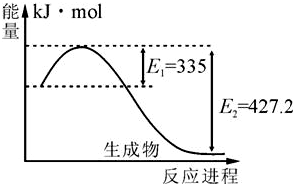 氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: 2NH3(g)△H<0,得到如下数据:
2NH3(g)△H<0,得到如下数据:| 实验组 | 温度/℃ | 起始量/mol | 2分钟/mol | 平衡常数 | |
| H2 | N2 | NH3 | |||
| 1 | 298 | 6 | 2 | 1.2 | 4.1×106 |
| 2 | 398 | 3 | 1 | 0.8 | K1 |
| [c(NH3)]2 |
| c(N2)[c(H2)]3 |
| [c(NH3)]2 |
| c(N2)[c(H2)]3 |
 NH3?HDO+D+
NH3?HDO+D+ NH3?HDO+D+
NH3?HDO+D+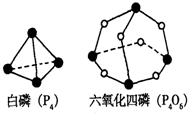 (1)在25℃、101kPa状况下,4g氢气和适量氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
(1)在25℃、101kPa状况下,4g氢气和适量氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:| 实验 序号 |
金属 质量/g |
金属 状态 |
C(H2SO4) /mol?L-1 |
V(H2SO4) /mL |
溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com