
题目列表(包括答案和解析)
①硅酸盐及其制品性质稳定,熔点很高,都难溶于水 ②生产光导纤维的主要原料是玻璃③玻璃是硅酸钠、硅酸钙、二氧化硅的熔合物④制取普通玻璃和普通水泥的原料中均有石灰石 ⑤高岭石Al2(Si2O5)(OH)4可以表示成Al2O3·2SiO2·2H2O,因为硅酸盐是由氧化物组成的 ⑥水泥具有水硬性,故水泥不能进行水下施工 ⑦钢化玻璃和水晶玻璃都是普通玻璃加热软化,然后急速冷却而制成的高强度玻璃
硅酸钠是硅酸盐的代表物,教材中设计实验探究了硅酸钠与酸的反应和硅酸钠的防火性.在教材实验的基础上,我们适当拓展,整合实验验证硅酸钠的性质.
[实验目的]探究硅酸钠的性质
[实验原理]硅酸钠可以与酸反应
[实验仪器]试管、胶头滴管、分液漏斗、导管、洗气瓶、烧杯、滤纸、激光笔、玻璃片、表面器皿等
[选用药品]饱和硅酸钠溶液、1 mol/L盐酸、石灰石、饱和碳酸氢钠溶液、酚酞溶液、蒸馏水、氯化钙溶液、饱和碳酸钠溶液等
[实验步骤](1)按下图所示安装实验装置.

(2)检验装置气密性:在B、C、D中装入适量蒸馏水,浸没导管口,关闭分液漏斗的活塞,用酒精灯微热烧瓶,若观察到B、C、D的导管口都产生气泡,停止微热,D烧杯中的导管形成一段水柱,表明装置的气密性良好.
(3)装入药品进行实验.观察现象并填写下表:
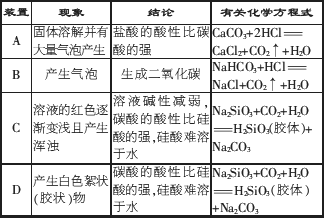
酸性:
HCl>H2CO3>H2SiO3.(4)在另一只烧杯E中装入饱和硅酸钠溶液,与D烧杯做对照实验:在暗处,用激光笔照射D、E烧杯里的液体,观察现象.
现象及结论:可以观察到D烧杯的液体发生了丁达尔现象,说明生成的硅酸在水中形成的是胶体.
(5)取甲、乙两支试管,分别装入相同体积的饱和硅酸钠溶液,甲中加入几滴盐酸、乙中加入几滴氯化钙溶液,观察现象.然后分别加入足量的氢氧化钠溶液,再观察现象.
现象及结论:甲中出现白色沉淀,后白色沉淀溶解;乙中也出现白色沉淀,但沉淀不溶解.有关的化学方程式为Na2SiO3+2HCl![]() 2NaCl+H2SiO3(胶体)+2NaCl,H2SiO3+2NaOH
2NaCl+H2SiO3(胶体)+2NaCl,H2SiO3+2NaOH![]() Na2SiO3+2H2O,Na2SiO3+CaCl2
Na2SiO3+2H2O,Na2SiO3+CaCl2![]() CaSiO3↓+2NaCl.
CaSiO3↓+2NaCl.
(6)取两块玻璃片,在一块玻璃片上滴几滴饱和硅酸钠溶液,将另一块玻璃片盖在上面,片刻后,移动玻璃片,观察现象.
现象:两块玻璃片粘在一起,不能移动.
(7)取三张分别被蒸馏水、饱和硅酸钠溶液、饱和碳酸钠溶液充分浸泡过的滤纸(分别记为A、B、C),取出稍沥干(不再滴液)后同时分别放在酒精灯火焰上点燃,观察现象.

[实验结论]根据上述实验说明硅酸钠可以溶于水,它的水溶液呈碱性且具有粘合性、防火性;硅酸钠与碳酸、盐酸等酸反应会生成硅酸,硅酸是弱酸,难溶于水,在水中可以形成胶体.硅酸钙难溶于水.
[问题与讨论](1)如果拆掉上述实验装置B,能否证明碳酸的酸性比硅酸的强?
(2)硅酸钠溶液为什么俗称“泡花碱”?
(3)设计一个简单的实验探究硅酸钠、碳酸钠溶液的碱性强弱.简述实验步骤、现象、结论.
(1)写出上述内容涉及的化学方程式。
(2)制取甲硅烷的装置与制取________(填“氧气”“氢气”或“氯气”)的装置相似。
(3)加入稀盐酸之前应向密闭装置中通入一会儿氮气,其目的是______________。
(4)收集甲硅烷气体只能采用________法,这是因为________。收集完甲硅烷气体后不能直接将导气管从水槽中取出,这是为了防止________,正确的操作方法是________________。
(5)为了研究甲硅烷的化学性质,进行如下实验:①将甲硅烷通入少量的高锰酸钾酸性溶液中,发现有二氧化锰生成,同时还生成了所有气体中最轻的气体,然后经测定得知所得溶液为无色的硅酸钾(K2SiO3)溶液,该反应的化学方程式为_______________________。②将甲硅烷通入少量的硝酸银溶液,发现有沉淀生成,然后经测定得知沉淀为混合物,其中有二氧化硅。向充分反应后的溶液中滴入几滴稀盐酸,未发现有白色沉淀生成;向反应后的原溶液中滴入几滴碳酸钠溶液,却发现有气泡迅速放出。则将甲硅烷通入硝酸银溶液中,发生反应的化学方程式为____________________________________。
(6)制完甲硅烷后,检验装置中是否有残留的甲硅烷的方法是_________________________。
| A.干馏煤可以得到甲烷、苯和氨等重要化工原料 |
| B.用于奥运“祥云”火炬的丙烷是一种清洁燃料 |
| C.用大米酿的酒在一定条件下密封保存,时间越长越香醇 |
| D.玛瑙和餐桌上的瓷盘都是硅酸盐制品 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com