
题目列表(包括答案和解析)
(15分)能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
I.已知:Fe2O3(s)+3C(石墨) =2Fe(s)+3CO(g) △H=akJ·mol-1
CO(g)+1/2O2(g)= CO2(g) △H=bkJ·mol-1
C(石墨)+O2(g)=CO2(g) △H=ckJ·mol-1
则反应:4Fe(s)+3O2(g)= 2Fe2O3(s)的焓变△H= kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)= 2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应。
负极: ,
正极: 。
(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂。ClO2是一种黄绿色气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下:
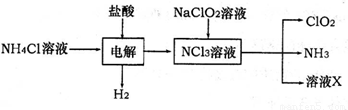
已知:电解过程中发生的反应为:
NH4Cl+2HCl NCl3+3H2↑;假设NCl3中氮元素为+3价。
NCl3+3H2↑;假设NCl3中氮元素为+3价。
①写出电解时阴极的电极反应式 。
②在阳极上放电的物质(或离子)是 。
③除去ClO2中的NH3可选用的试剂是 (填序号)
A.生石灰 B.碱石灰 C.浓H2SO4 D.水
④在生产过程中,每生成1mol ClO2,需消耗 mol NCl3。
下列两种气体的分子数一定相等的是( )
A.质量相等、密度不等的N2和C2H4 B.等体积、等密度的CO和C2H4
C.等温、等体积的O2和N2 D.等压、等体积的N2和CO2
这道题源于人民教育出版社化学教材第一册53页第二大题第5题,原题如下:
在相同条件下,下列气体中所含分子数目最多的是( )
A.1 g H2 B.10 g O2 C.30 g Cl2 D.17 g NH3
上述两题均为比较数目分子的。课本题目重点考查基本公式:N=nNA,n=m/M。高考题在本题基础上进行了拓展,重点考查阿伏加德罗定律及其推论。不论怎样考查,大家记住气体物质的量的大小决定分子数的多少即可。
研究SO2、CO等大气污染物的处理与利用具有重大意义。
Ⅰ.利用钠碱循环法可脱除烟气中SO2,该法用Na2SO3溶液作为吸收剂,吸收过程pH随n(SO)?n(HSO3-)变化关系如下表:
| n(SO32-)?n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
 CH3OH(g)。
CH3OH(g)。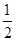 O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。| 化学键 | H—H | H—O | C—H | C—O | C=O |
| 键能 | 435 | 463 | 413 | 356 | 745 |
寻找理想的新能源和更加有效的利用已有能源是现在能源问题研究的两个主要方向。
I.实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_________(填序号)。
A.2H2(g)+O2(g)=2H2O(l) △H=-142.9kJ/mol
B.H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
C.2H2+O2=2H2O(l) △H=-571.6kJ/mol
D.H2(g)+1/2O2(g)=H2O(g) △H=-142.9kJ/mol
Ⅱ.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O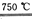 CaO+2HBr
CaO+2HBr
②2HBr+Hg HgBr2+H2↑
HgBr2+H2↑
③HgBr2+___ ___+___
___+___
④2HgO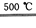 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:__________________;根据“绿色化学”的思想评估该方法制H2的主要缺点:________________
Ⅲ.氢气通常用生产水煤气的方法制得,其中CO(g)+ H2O(g) CO2(g)+H2(g) △H<0。在850℃时,K=1。
CO2(g)+H2(g) △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K____(填“大于”“小于”或“等于”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0molH2O、1.0molCO和xmolH2,则:
①当x=5.0时,上述平衡向___(填“正反应” 或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是____。
(3)在850℃时,若设x=5.0mol和x=6.0mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a____(填“大于”“小于”或“等于”)b。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com