
题目列表(包括答案和解析)
A.6 B.7? C.9 D.10?
A.6 B
加热某NaHCO3和Na2CO3·xH2O的混合物40 g,到不再产生气体为止,得残留固体21.2 g。把加热过程中产生的气体全部通入含有0.05 mol Ba(OH)2的溶液中,恰好使生成的沉淀完全消失,则x为( )?
A.6 B.7? C.9 D.10?
①石蕊试纸(检验气体):。?
②滴定管: 。?
③集气瓶(收集氨气): 。?
④托盘天平 。?
(Ⅱ)目前国际油价居高不下。乙醇汽油是指在汽油中加入10%的乙醇(体积比)。乙醇汽油具有辛烷值高、抗爆性好的特点,推广使用可缓解能源紧缺、促进国民经济发展。汽油中添加的乙醇不能含水,否则会影响发动机正常运转和使用寿命。制备无水乙醇可采取如下方法:??
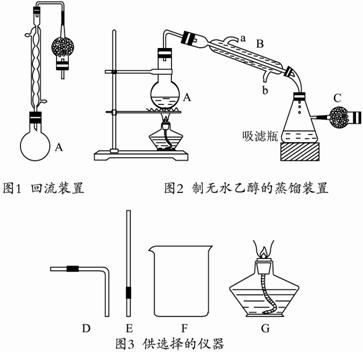
①在250 mL圆底烧瓶中加入95%的乙醇100 mL和新制的生石灰30 g,在水浴中加热回流1至2小时。(如图1所示)?
②取下冷凝管,改成如图2所示的装置,再将A置于水浴中蒸馏。?
③把最初蒸出的5 mL馏出液另外回收。?
④用烘干的吸滤瓶作为接受器,其侧管接一支装有CaCl2的干燥管C,使其与大气相通,蒸至无液滴出来为止,即得99.5%的酒精。试回答:?
(1)已知在101 kPa、25 ℃时,?
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);ΔH =-1 367 kJ·mol-1??
1 g乙醇完全燃烧生成液态水时放出 热量。?
(2)图2中的干燥管C的作用是 。仪器B的名称是 ,冷凝水是从口 (填“a”或“b”)进入冷凝管。?
(3)无水CaCl2常用作吸水剂,在烧瓶A中能否用无水CaCl2代替生石灰? (填写“能”“不能”),原因是 。?
(4)检验所得产品中是否含水的操作方法是 。
(5)某同学想要检验图2装置的气密性,他可从图3中选择哪几种仪器(填仪器代号) 。请简述检验气密性的操作过程 。?
(6)写出由葡萄糖转化为酒精的化学方程式: 。?
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请把导管补充完整。(在原图中画即可)
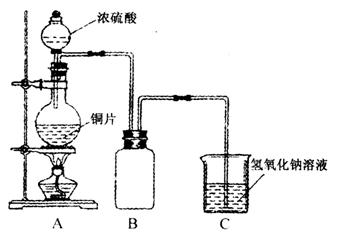
(2)实验中他们取6.4 g铜片和12 mL18 mol·1-1浓硫酸放在圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:_________________________________________。
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是:____________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:_________________(填写字母编号)。
A.铁粉 B.BaCl2溶液
C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是______________________(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量的用稀硫酸酸化的KMnO4溶液,再加入足量的BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况下)
D.将装置A产生的气体缓缓通入足量的氢氧化钡溶液中,反应完全后,过滤、洗涤、干燥,称最沉淀
②乙学生没计的方案是:向反应后的溶液中加蒸馏水稀释至1000 mL,取20 mL于锥形瓶中,滴入2—3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测出消耗NaOH溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生没计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“否”),其理由是_______。
(4)请再设计一个可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com