现有
aA、
bB、
cC、
dD、
eE五种短周期元素,它们都是生命体不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体.B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但有一点是肯定的,那就是没有第三种元素的化合物种数会超出它们.回答下列有关问题:
(1)写出C
2A
4的电子式
.C
2A
4的水溶液呈
碱
碱
(填“酸”“碱”或“中”)性,1mol C
2A
4最多可以与
2
2
mol HCl发生中和反应生成正盐.C
2A
4和A
2D
2 既具有氧化性,又具有还原性,从化合价的角度解释C
2A
4和A
2D2 既具有氧化性又具有还原性的原因
N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性
N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性
.
(2)A和B可以形成很多种化合物,用电子式表示A和B形成的最简单化合物的形成过程:
,该化合物与CA
3和A
2D的熔点由高到低的顺序为
H2O>NH3>CH4
H2O>NH3>CH4
(用化学式表示).
(3)燃料电池是一种新型电池.由A、B、D组成的一种日常生活中最常见的有机物与D的单质以KOH溶液为电解质组成电池,引起了人们的普遍重视.写出负极的电极反应式:
CH3CH2OH-12e-+16OH-═2CO32-+11H2O
CH3CH2OH-12e-+16OH-═2CO32-+11H2O
.
(4)E的同素异形体中有一种通常情况下不稳定,在空气中极易自燃,写出该同素异形体的结构式
,CA
3、A
2D、EA
3的热稳定性由强到弱的顺序为
H2O>NH3>PH3
H2O>NH3>PH3
(用化学式表示).







 CH3COO-+H+
CH3COO-+H+ CH3COO-+H+
CH3COO-+H+
 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 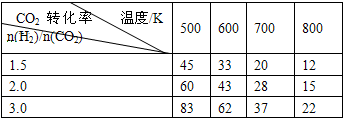


 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 
