合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH
4(g)+H
2O(g)?CO(g)+3H
2(g)△H
1=+206.1kJ/mol
②CH
4(g)+CO
2(g)?2CO(g)+2H
2(g)△H
2=+247.3kJ/mol
③CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H
3请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH
4的物质的量浓度随反应时间的变化如图1所示.10min时,改变的外界条件可能是
升高温度
升高温度
.
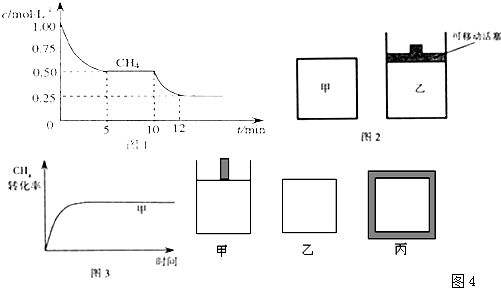
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH
4和CO
2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH
4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH
4的转化率随时间变化的图象.
(3)反应③中△H
3=
-41.2kJ/mol
-41.2kJ/mol
.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO |
H2O |
CO2 |
H2 |
| 0.5mol |
8.5mol |
2.0mol |
2.0mol |
此时反应③中正、逆反应速率的关系式是
a
a
(填代号).
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(4)800K时下列起始体积相同的密闭容器中充入2mol SO
2、1mol O
2,其反应是2SO
2(g)+O
2(g)?2SO
3(g);△H=-96.56kJ?mol
-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡.
①达到平衡时,平衡常数K(甲)
=
=
K(乙)
>
>
K(丙)(填“>”、“<”或“=”).
②达到平衡时SO
2的浓度C(SO
2)(甲)
<
<
C(SO
2)(乙
<
<
C(SO
2)(丙)(填“>”、“<”或“=”).



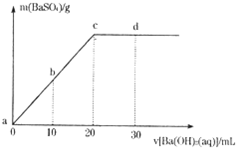 常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )
常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )