
题目列表(包括答案和解析)
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- |
K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- |
K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- |
K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
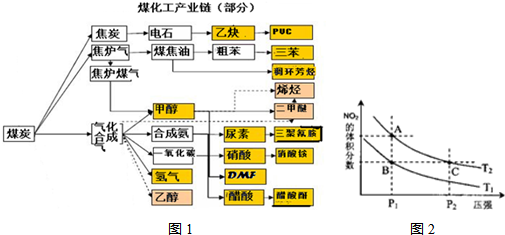
在理解概念的基础上,合理分类,构建知识网络是学习化学的重要方法,右图是中学化学常见某化学概念之间的相互关系。

(1)完成下表,实例物质的化学式按以下要求填写。
①只能由H、O、N,Si、S元素中的一种或几种组成物质;
②在组成各实例物质中每种元素只能出现一次,化合物中最多含一种原子团;
③所填物质必须能够回答问题(2)(3)(4)(5)。
|
| A | B | C |
|
| 晶体类别 | 离子晶体 | 分子晶体 | 原子晶体 | 金属晶体 |
| 实例的化学 | Na |
(2)取上述(1)表中A、B、C三种晶体中某一晶体溶于水得W溶液,写出等物质的量浓度等体积的硫酸氢钠与W溶液反应的离子方程式 ;
(3)A的实例物质的水溶液中含有中性微粒____ 种;
| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
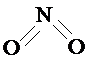 和
和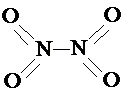 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式已知a、b、I、K四种粒子都有10个电子,其结构特征如下:

A可作为工业上生产酸J的原料,B、C为非金属单质,E为红棕色固体,物质D由a、b构成,G是一种消毒剂的主要成分.各物质之间的转化关系如下图所示(个别产物略去).
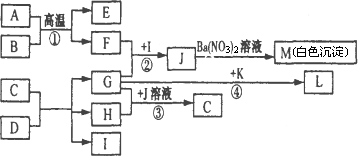
请回答下列问题:
(l)考虑到综合经济效益,工业生产K时,可采取的措施有________(填序号).a.使用催化剂 b.适当降低温度 c.适当增大压强 d.及时分离出产物 e.对原料进行循环利用 f.充分利用反应本身放出的热量 g.工厂地址选择在交通发达的大城市
(2)写出反应②的离子方程式:________________.
(3)反应④中,G(溶液)与K能以物质的量之比为1∶2反应生成L、H、I.L是一种火箭燃料,其分子中各原子均已达稳定结构.则L的电子式为________,该反应的化学方程式为________________.
(4)将F通入含等物质的量的D的溶液中,反应后的溶液能使甲基橙显红色,则此溶液中各微粒浓度的守恒关系是________________(只写一种).
(5)工业上反应①应在________(填设备名称)中进行.现有1 mol A参加反应,假设各步均反应完全,生成M的质量为1165 g,生成E的质量为320 g,则反应①的化学反应方程式为________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com