
题目列表(包括答案和解析)
下图是两座工厂的主要生产流程以及它们之间的生产关系
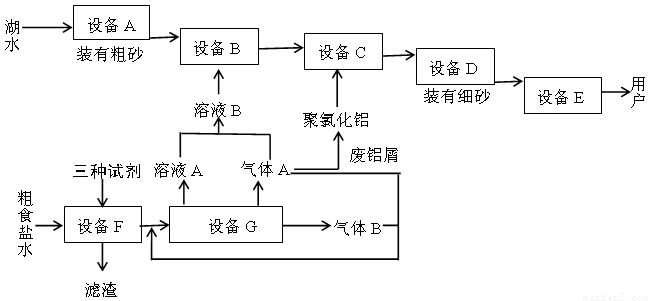
回答下列问题:
(1)与上图中“设备A”的作用相当的实验装置是???????? 。

(2)“溶液B”也可以用下列物质中的什么物质代替?????? 。
a.KAl(SO4)2·12H2O????? b.ClO2??????? c.大量O3????? d.K2Cr2O7?????? e.活性炭
(3)聚氯化铝在生产过程中作??????? 剂,其作用是????????????? ,可用离子方程式表示其化学原理如下(用Al3+代表聚氯化铝):??????????????????????? 。
(4)上图中下方的工厂主要生产两种气体和一种常见强碱,通常称为????????? 工业。
(5)加入“三种试剂”主要是为了除去粗食盐水中的Ca2+、Mg2+、SO42-等杂质,按加入的先后次序写出化学式??????????????????????????? 。
(6)制取“溶液B”的方法现在已作了改进,其原理图,用离子方程式表示该装置中发生的反应:????????????????????? 。

下图是两座工厂的主要生产流程以及它们之间的生产关系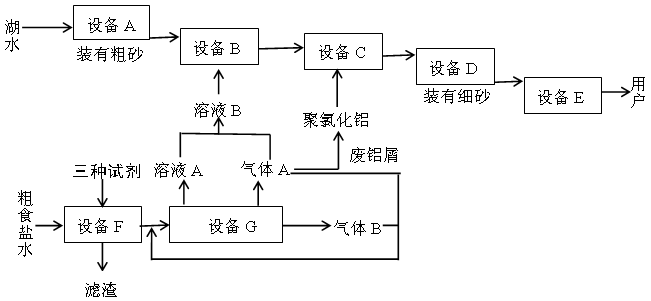
回答下列问题:
(1)与上图中“设备A”的作用相当的实验装置是 。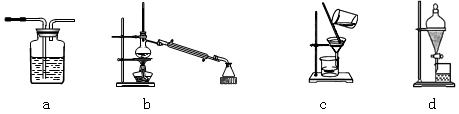
(2)“溶液B”也可以用下列物质中的什么物质代替? 。
a.KAl(SO4)2·12H2O b.ClO2 c.大量O3 d.K2Cr2O7 e.活性炭
(3)聚氯化铝在生产过程中作 剂,其作用是 ,可用离子方程式表示其化学原理如下(用Al3+代表聚氯化铝): 。
(4)上图中下方的工厂主要生产两种气体和一种常见强碱,通常称为 工业。
(5)加入“三种试剂”主要是为了除去粗食盐水中的Ca2+、Mg2+、SO42-等杂质,按加入的先后次序写出化学式 。
(6)制取“溶液B”的方法现在已作了改进,其原理图,用离子方程式表示该装置中发生的反应: 。
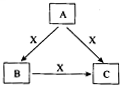 A、B、C、X是中学化学常见物质,转化关系如图所示.请针对以下不同情况回答问题:
A、B、C、X是中学化学常见物质,转化关系如图所示.请针对以下不同情况回答问题:
| ||
| ||
 如右框图反应中所涉及的l4种物质都是由短周期元素组成的.已知:
如右框图反应中所涉及的l4种物质都是由短周期元素组成的.已知:

| ||
| △ |
| ||
| △ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com