
题目列表(包括答案和解析)
现有甲、乙、丙、丁4种短周期元素,甲元素M电子层上的电子数是K电子层上电子数的一半,该元素的单质在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置;乙元素的单质在室温下、冷的浓硫酸或空气中,表面都能生成致密的氧化膜;丙元素的单质在室温下是黄绿色气体;丁元素的阴离子与丙元素的阴离子具有相同的电子层结构.
(1)写出甲、乙、丙、丁4种元素的符号.甲:________ 乙:________ 丙:________ 丁:________
(2)甲元素和乙元素最高价氧化物对应的水化物碱性较强的物质的化学式是________.
(3)由甲元素和丁元素组成的盐溶液的pH________7(填>、<、=).
(4)将乙元素的单质(除去氧化膜)投入浓氯化铜溶液中,在其表面很快出现一层红色物质,产生气体的速率逐渐加快,触摸容器壁得知溶液温度迅速升高,收集气体,检验其具有可燃性.产生的气体是________(写化学式).请从有关能量、是否有电化学作用等方面分析开始阶段产生气体的速率不断加快的原因:________________.
(16分)下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | ⑥ | |
| | ⑦ | | | | | | | | | | | | | | ⑧ | | |
| | | | | | ⑨ | | | | | ⑩ | | | | | | | |

(16分)下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
|
⑧ |
|
|
|
|
|
|
|
|
⑨ |
|
|
|
|
⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑨原子的外围电子排布式 。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
(3)按要求完成下列各题
a.第一电离能:元素④ 元素⑤(选填“>”、“=”、“<”)。
b.与元素④所形成的单质互为等电子体的分子、离子的化学式 、 (各写一种)。
c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________________________
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质。则其负极反应式为_____________________________。
(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子。0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。该反应的热化学方程式为_________________________
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
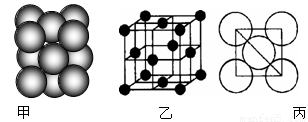
(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。 已知该原子的半径为d,相对原子质量为M,NA代表阿伏加德罗常数,请回答:
晶体中该原子的配位数为 ,一个晶胞中包含的原子数目为 ;该晶体的密度为 (用字母表示)
称取三份锌粉,分别盛在三只锥形瓶中,按下列要求另加物质后,塞上带导管的塞子,测定生成H2的体积。锥形瓶甲中加入2 mol/L的盐酸10mL,乙中加入2 mol/L的醋酸10mL,丙中加入2 mol/L的醋酸10mL及少量CuSO4粉末。若反应终了,生成H2体积相同,且锌没有剩余。请在小题⑴、⑵中用>、=或<回答:
(1)反应刚开始时甲、乙和丙中反应速率V的大小关系为 。
(2)三只锥形瓶中参加反应的锌的质量m大小关系为 。
(3)简要说明在反应过程中乙、丙中反应的速率不同的理由是 。
(4)为了加快甲反应产生H2的速率采取的下列措施可行的是 。
A.升高温度 B.加入浓硝酸 C.加入醋酸钠晶体 D.加入氯化钠晶体
| |||||||||||||||||||||||||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com