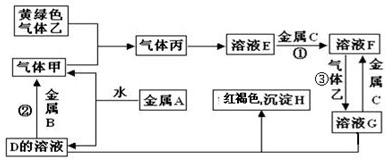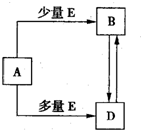
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
(1)若A、B、D的焰色反应均为黄色,且E为一种酸性的温室气体.
①写出A溶液→B溶液的离子方程式
2OH-+CO2═CO32-+H2O
2OH-+CO2═CO32-+H2O
.
②下面关于化合物A、B、D的说法正确的是
AC
AC
.
A.等物质的量的D与A均匀混合加热最后可得纯净物
B.用稀盐酸和澄清石灰水及相应的仪器即可检验D溶液中是否含B
C.用A溶液即可鉴别CuSO
4、FeCl
2、Fe
2(SO
4)
3、Al(NO
3)
3、KAlO
2溶液
D.往28.6g B?10H
2O晶体中缓慢加入10ml 1mol?L
-1H
2SO
4可得22.4L气体E
(2)若A为一种金属的盐酸盐RCl
3,R与盐酸或氢氧化钠溶液反应均产生氢气.
①写出R与氢氧化钠溶液恰好反应得到的溶液中离子浓度的大小顺序
c(Na+)>c(AlO2-)>c(OH-)>c(H+)
c(Na+)>c(AlO2-)>c(OH-)>c(H+)
.
②写出A溶液与D溶液反应的离子方程式
Al3++3AlO2-+6H2O═4Al(OH)3↓
Al3++3AlO2-+6H2O═4Al(OH)3↓
.
(3)若A与D相遇会产生白烟,则①实验室制取A的化学方程式为
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
.②B中的化学键类型为
离子键和极性键(或共价键)
离子键和极性键(或共价键)
.③检验A的方法及结论为
用湿润的红色石蕊试纸,若变蓝则证明为氨气
用湿润的红色石蕊试纸,若变蓝则证明为氨气
.

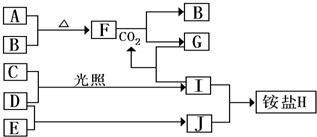

 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).