
题目列表(包括答案和解析)
 在密闭容器中进行如下反应:mA(g)+nB(g)?pC(g),反应经5min达到平衡,测得此时A的浓度减小了a mol?L-1,而C的浓度增加了
在密闭容器中进行如下反应:mA(g)+nB(g)?pC(g),反应经5min达到平衡,测得此时A的浓度减小了a mol?L-1,而C的浓度增加了| 2 |
| 3 |
| c2(C) |
| c3(A)?c(B) |
| c2(C) |
| c3(A)?c(B) |
如图1所示,可逆反应:mA(g)+nB(g) xC(g),在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是 ( )
xC(g),在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是 ( )
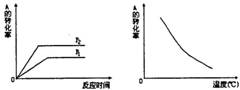
A.放热,m+n>x
B.放热,m+n<x
C.吸热,m+n<x
D.吸热,m+n>x
如图1所示,可逆反应:mA(g)+nB(g)![]() xC(g),在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是 ( )
xC(g),在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是 ( )
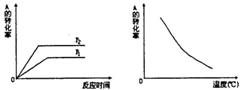
A.放热,m+n>x
B.放热,m+n<x
C.吸热,m+n<x
D.吸热,m+n>x
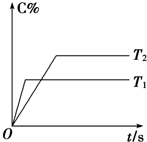
(6分)在密闭容器中进行如下反应:mA(g)+nB(g)  pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
(1)写出上述化学方程式中各物质的计量数:m=________,n=________,p=________
(2)压强一定时,C的百分含量(C%)与温度、时间(T表示温度,t表示时间)的关系如图所示。由此可知,该反应为 (填“吸热”或“放热”)反应。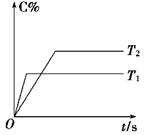
(3)该反应的平衡常数表示式为 ,升高温度,K值将 (填“增大”、“减小”或“不变”)。
经长期实践,人们总结出反应速率和反应物浓度之间存在定量关系:恒温下,对简单反应来说,化学反应速率同反应物浓度的方次的乘积成正比(反应物浓度的方次等于反应方程式中各物质的化学计量数)。如对于反应mA+nB![]() C来说,v=kc(A)m·c(B)n,其中k为常数。
C来说,v=kc(A)m·c(B)n,其中k为常数。
思考:今有一反应aA+bB![]() C,在25 ℃时,将A、B溶液按不同浓度混合,得到下列实验数据:
C,在25 ℃时,将A、B溶液按不同浓度混合,得到下列实验数据:
A的浓度mol·L-1 | B的浓度mol·L-1 | 反应速率vmol·L-1·s-1 |
1.0 | 1.0 | 1.2×10-2 |
1.0 | 4.0 | 1.92×10-1 |
4.0 | 1.0 | 4.8×10-2 |
分析以上数据,求出a、b的值。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com