
题目列表(包括答案和解析)
X、Y、Z、M均为短周期非金属元素,其原子序数按由小到大排列。X可分别与Y、Z、M组成10电子共价化合物。X、Z、M三种元素可形成离子化合物。
(1) 写出元素的名称:X. ,Z. 。
(2) 已知有反应2ZX3+3CuO=Z2+3Cu+3X2O,利用下图所示装置和必要的用品,可以进行制取ZX3并证明ZX3具有还原性的实验。
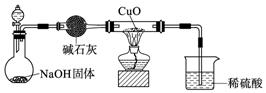
① 分夜漏斗中的溶液可能是 或 (填写名称)。
② 证明ZX3具有还原性的实验现象是 。
③ 上述装置有一不当之处,请在下面方框中画出改进部分的装置图。

(3) 物质的检验和分离,是化学实验的基本操作。
① X与Z元素可共同组成一种常见的阳离子,写出检验该离子的实验操作及现象。
实验操作: ;
现象: 。
② 下列混合物的分离和提纯方法:① 渗析② 蒸馏③ 过滤④ 分液,其中基本原理相近的是下列的 (填序号)。
A. ①和② B. ③和④ C. ①和③ D. ②和④
Ⅰ、物质的分离和提纯有多种方法。物质分离、提纯方案的设计在科学研究和工业生产中占有十分重要的地位。工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等,已知SiO2是不溶于水的酸性氧化物,Fe2O3是不溶于水的碱性氧化物)。某研究小组设计的提纯Al2O3的方案如下:
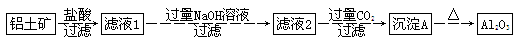
(1)写出沉淀A的化学式:___________________________________________________。
(2)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________________________。
(3)写出由沉淀A―→Al2O3的化学方程式:________________________,通入过量CO2生成沉淀A时反应的离子方程式为_______________________________________________。
Ⅱ、按照要求回答下列问题:
A、B、C、D、E是常见化合物或单质,有如下转化关系 (略去条件和副产品)。
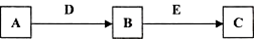
(1)若A为黄绿色气体单质,D、E为生活中常见的两种金属,其中E是一种红色光亮的物质。
① 写出向B的溶液中加入足量D的离子反应方程式_____________________________________。
②向①所得的溶液中加入NaOH溶液,并在空气中放置的现象是:_________________________,写出固体在空气中放置的化学反应方程式:__________________________________________。
海水资源的利用将走综合开发的道路,一次提取海水,同时提取多种物质。下图是某工厂对海水资源综合利用的示意图。

试回答下列问题:
(1)提纯粗盐后的母液中含有K+、Mg2+、Na+等阳离子,对母液进行一系列的加工可以制得金属镁。
①从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产石灰乳的化学方程式是__________________________________________。
②从离子反应的角度思考,在母液中加入石灰乳的目的是____________________________;
③在生产中,常涉及反应MgCl2·6H2O![]() MgCl2+6H2O,该反应需要在HCl气氛中才能顺利完成,其理由是_______________________。
MgCl2+6H2O,该反应需要在HCl气氛中才能顺利完成,其理由是_______________________。
(2)在提取Mg(OH)2后和剩余母液中加入一种常见的气态氧化剂,又可制取重要的化工原料溴单质。
①生产中将溴单质从混合物中分离出来的方法是_________________。
②以下是对生产溴单质所用的气态氧化剂寻找提供货源的设想,其中合理的是___________。
A.从外地购买
B.从本厂生产烧碱处循环
C.从本厂生产镁单质处循环
D.在当地新建生产工厂
③从多种经营综合开发,打造大而强的现代化企业及本厂生产所需要的原料等方面来看,你认为该厂还可以再增加的生产项目是_________________。
 (2013?金华模拟)最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如下:
(2013?金华模拟)最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如下: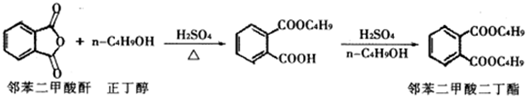


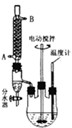
某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。

请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);竖直冷凝管的主要作用是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物,已知B、C装置中为常见物质的水溶液。
B装置检验的物质是_________,写出C装置中主要的化学方程式:_______________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
物质 | 熔点/℃ | 沸点/℃ |
1-丁醇 | -89.5 | 117.3 |
1-溴丁烷 | -112.4 | 101.6 |
丁醚 | -95.3 | 142.4 |
1-丁烯 | -185.3 | -6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭_______,打开_______;
④接通冷凝管的冷凝水,使冷水从______处流入;
⑤迅速升高温度至_______℃,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com