
题目列表(包括答案和解析)
不同的金属在化学反应中表现出来的活泼程度不同,瑞典化学家贝采里乌斯和俄国化学家贝开托夫称之为金属活动顺序.另一方面,同一金属在不同条件或不同化学反应中也可以表现出不同的活泼程度.
(1)根据金属活动性顺序,工业上冶炼金属可以采用不同的冶炼方法.其中可以用“热分解法”冶炼的金属有________.
(2)
工业上用氯化铁溶液腐蚀铜制电路板.根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序:________.(3)合金Fe-Cr在不同酸中反应情况不同,其在三种稀硫酸、稀硝酸和稀盐酸中的腐蚀速率如图所示,则下列有关说法正确的是________(填写序号).
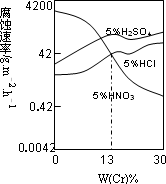
A.酸的氧化性越强,对该合金的腐蚀速率越大
B.稀硝酸对该合金的腐蚀性比另两种酸弱
C.合金中Cr含量增加,稀硝酸对该合金的腐蚀性减弱
(4)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质
(与酸不反应).某化学兴趣小组在实验室条件下,以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收.步骤一:电解精制电解时,粗铜应与电源的________极相连.电解过程中,硫酸铜的浓度会________(填“变大”、“不变”或“变小”).
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:________.
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
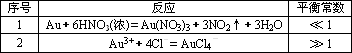
从表中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:________.
铬的化合物有毒,由于+6价Cr的强氧化性,其毒性是+3价Cr毒性的100倍。因此,必须对含铬的废水进行处理。目前研究和采用的处理方法主要有:
方法一、还原法:
(Ⅰ)在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下: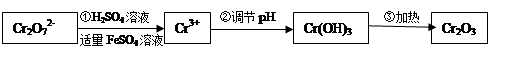
请回答下列问题:
(1)上述流程①发生反应的离子方程式是 。
(2)若在① 使FeSO4适当过量、空气适量,可产生具有磁性、组成类似于铁氧体(Fe3O4或FeO·Fe2O3)的复合氧化物(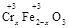 ·y
·y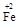 O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(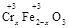 ·y
·y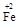 O)化学式是 。
O)化学式是 。
(Ⅱ)研究发现,用铁粉作还原剂不仅可以除去Cr6+,还能除去废水中的少量Mn2+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,
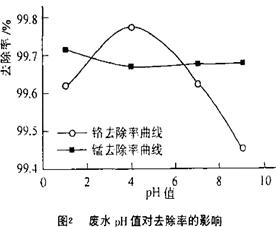
(3)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为 时锰、铬去除率最好
(4)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH= 时锰、铬去除率最好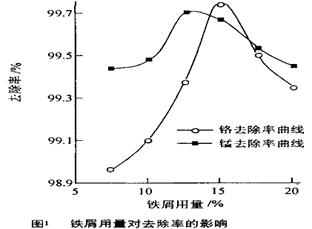
方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(5)写出此阴极反应的电极方程式 。
(6)现用上法处理1×104 L含铬(+6价)78 mg / L的废水,电解时阳极物质消耗的质量至少为________kg。
(15分)1、下列有关元素锗及其化合物的叙述中正确的是 ___________
| A.锗的第一电离能高于碳而电负性低于碳 |
| B.四氯化锗与四氯化碳分子都是四面体构型 |
| C.二氧化锗与二氧化碳都是非极性的气体化合物 |
| D.锗和碳都存在具有原子晶体结构的单质 |
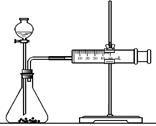
(10分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼, 反应速率越快。 |
(8分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。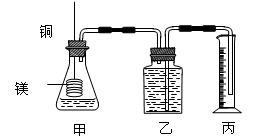
(1)甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com