
题目列表(包括答案和解析)
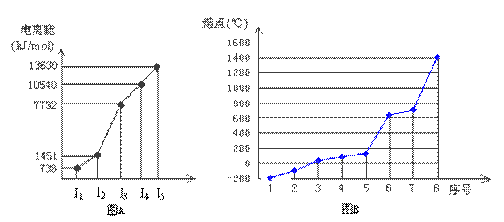
(1)短周期某主族元素M的电离能情况如图A所示.则M元素位于周期表的第________族.

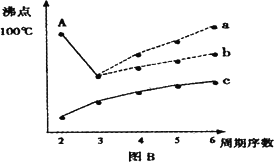
(2)下图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第________族元素氢化物的沸点的变化规律.不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是:________,理由是:________.
(3)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti).钛被誉为“未来世纪的金属”.试回答下列问题:
①22Ti元素基态原子的价电子层排布式为________.
②金属钛的堆积方式是________.
③钛合金,密度小、比强度高、耐腐蚀性强,用于涡轮发动机和飞机构架,其缺点是在一定条件下会燃烧,目前阻燃钛合金是工程实用化的主攻方向.钛合金在物质分类中属于________(填“混合物”或“化合物”).
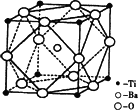
④在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如下图,则它的化学式是________.
(18分)(1)I.短周期某主族元素M的电离能情况如右图(A)所示。则M元素位于周期表的第 族。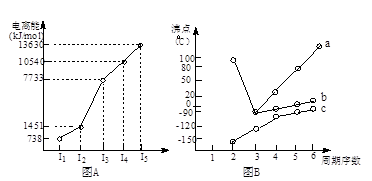
II.图B折线c可以表达出第 族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:__________(填“a”或“b”)
III.部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  |  |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
[化学——物质结构与性质](13分)
(1)金属钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,写出Ti元素的基态原子电子排布式为 ;
(2)日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素,该元素基态原子未成对电子数为 。
(3)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间的共价键含有 (填字母): a.2个σ键;b.2个π键;c.1个σ键、1个π键。
(4)①短周期某主族元素M的逐级电离能情况如下图A所示,则M元素位于周期表的第
族。
②第三周期8种元素按单质熔点高低的顺序如下图B所示,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图B中的序号)。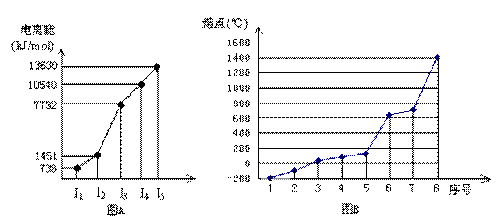
(5)由C原子跟Si原子以1 : 1相互交替结合而形成的晶体,晶型与晶体Si相同。两者相比熔点更高的是 (填化学式)试从结构角度加以解释: 。
(6)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是 。
[化学——物质结构与性质]
(1)金属钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,写出Ti元素的基态原子电子排布式为 ;
(2)日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素,该元素基态原子未成对电子数为 。
(3)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间的共价键含有 (填字母): a.2个σ键;b.2个π键;c.1个σ键、1个π键。
(4)①短周期某主族元素M的逐级电离能情况如下图A所示,则M元素位于周期表的第
族。
②第三周期8种元素按单质熔点高低的顺序如下图B所示,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图B中的序号)。
(5)由C原子跟Si原子以1 : 1相互交替结合而形成的晶体,晶型与晶体Si相同。两者相比熔点更高的是 (填化学式)试从结构角度加以解释: 。
(6)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是 。
| 元素 | 结构、性质等信息 |
| X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
| Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质 |
| Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
| M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com