Ⅰ、下面A~E是中学化学实验中常见的几种实验装置,试回答下列问题:

(1)请为进行下列实验挑选合适的装置(填序号字母)
①量气装置是…
A
A
②过滤装置是…
C
C
③蒸发装置是…
D
D
④蒸馏装置是…
E
E
⑤消石灰与氯化铵共热制NH
3选用
B
B
⑥I
2的CCl
4溶液中提取I
2选用
E
E
(2)其中常用于物质的分离和提纯的装置是
CDE
CDE
(填序号),请另写出一种要用到分液漏斗进行分离和提纯的基本实验操作的名称
萃取分液
萃取分液
.
Ⅱ、某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
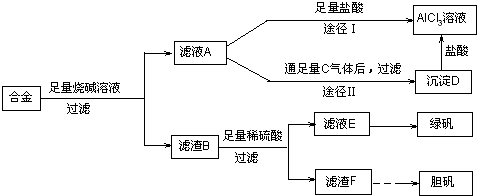
试回答下列问题:
(1)Al
3+的结构示意图为
,铝元素在周期表中的位置是
第三周期第ⅢA族
第三周期第ⅢA族
.
(2)由滤液A制得AlCl
3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是
途径Ⅱ更合理
途径Ⅱ更合理
,理由是
因为按途径I直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质
因为按途径I直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质
.
(3)从滤液E中得到绿矾晶体(FeSO
4?7H
2O)的实验操作是
蒸发浓缩、冷却结晶、洗涤、干燥
蒸发浓缩、冷却结晶、洗涤、干燥
.
(4)向滤渣F中加入稀硫酸,同时不断充入空气使F完全溶解,反应的化学方程式为:
2Cu+O2+2H2SO4=2CuSO4+2H2O
2Cu+O2+2H2SO4=2CuSO4+2H2O
.
(5)某同学为得到无水AlCl
3,他将AlCl
3溶液加热干,灼烧至质量不变为止,结果得到的是Al
2O
3.试结合必要的方程式和文字解释他得到的是Al
2O
3而不是AlCl
3的原因:
AlCl3+3H2O?Al(OH)3+3HCl,加热蒸发时,随HCl的挥发,平衡正向移动而生成Al(OH)3,灼烧时2Al(OH)3=Al2O3+3H2O,故得Al2O3而非AlCl3
AlCl3+3H2O?Al(OH)3+3HCl,加热蒸发时,随HCl的挥发,平衡正向移动而生成Al(OH)3,灼烧时2Al(OH)3=Al2O3+3H2O,故得Al2O3而非AlCl3
.




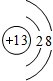
 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下

