
题目列表(包括答案和解析)
右图所示为冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种。
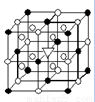
(1)图中●、○分别指代哪种粒子 、 ;大立方体的体心处▽所代表的是 。冰晶石在化工生产中的用途 。
(2)H2S和H2O2的主要物理性质比较如下:[来源:ZXXK]
|
|
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
H2S |
187 |
202[来源:学§科§网Z§X§X§K] |
2.6 |
|
H2O2 |
272 |
423 |
以任意比互溶 |
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因 ?
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
写出铜原子价电子层的电子排布式 ,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有 (填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是 。
右图所示为冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种。
(1)图中●、○分别指代哪种粒子 、 ;大立方体的体心处▽所代表的是 。冰晶石在化工生产中的用途 。
(2)H2S和H2O2的主要物理性质比较如下:
|
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因 ?
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
写出铜原子价电子层的电子排布式 ,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有 (填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是 。
 (1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种.图中●、○分别指代哪种粒子
(1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |




(15分)
(1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子 、 ;大立方体的体心处▽所代表的是 (用化学式表示)。
(2)H2S和H2O2的主要物理性质比较如下:
|
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因
。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有_______(填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com