Ⅰ下列实验操作或事故处理中,正确的做法是
BCD
BCD
A.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
C.配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高
D.配制FeCl
3溶液时,将FeCl
3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度E.在铁粉存在下用溴水和苯反应制取溴苯时,无需加热
F.取1mL 20%蔗糖溶液,加入适量稀硫酸,水浴加热约5min后,再加入少量新制的Cu(OH)
2,悬浊液加热,可检验蔗糖是否发生了水解
G.物质溶于水的过程中,一般有放热或吸热现象,若热效应不明显,溶解的操作可以在量筒中进行
Ⅱ在中学化学实验中,通常用无水硫酸铜来检验少量水的存在,然而,无水硫酸铜的吸湿性很强,需要时须现制现用.
方法Ⅰ:取2药匙细小的硫酸铜晶体置于
研钵
研钵
中研碎后放入坩埚,将坩埚放在泥三角上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入
干燥器
干燥器
中进行冷却.
方法Ⅱ:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干.
【交流与讨论】
(1)方法Ⅰ中,加热温度稍高时会出现变黑现象,原因是
CuSO
4?5H
2O
CuO+SO
3+5H
2O或CuSO
4?5H
2O
CuO+H
2SO
4+4H
2O也可
CuSO
4?5H
2O
CuO+SO
3+5H
2O或CuSO
4?5H
2O
CuO+H
2SO
4+4H
2O也可
(用化学方程式表示).
(2)方法Ⅱ中,浓硫酸的作用是
吸水剂
吸水剂
;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是
加CaO后蒸馏
加CaO后蒸馏
,所用的主要玻璃仪器有烧瓶、接液管、锥形瓶、酒精灯、
冷凝管
冷凝管
等.
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想
铜离子对双氧水分解有催化作用
铜离子对双氧水分解有催化作用
.

![]() FeCl2溶液
FeCl2溶液![]() FeCl3溶液
FeCl3溶液![]() FeCl3晶体
FeCl3晶体![]() CuO
CuO![]() CuSO4溶液
CuSO4溶液![]() 胆矾
胆矾![]() 静置几分钟刻痕处呈红色
静置几分钟刻痕处呈红色![]() AlCl3溶液
AlCl3溶液![]() AlCl3
AlCl3![]() Al
Al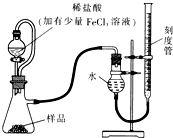 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.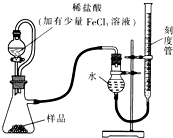 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.