
题目列表(包括答案和解析)
运用化学反应原理研究氮、氧、镁、铜等元素及其化合物的性质。
⑴合成氨反应反应:N2(g)+3H2(g)![]() 2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动 (填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH (填“增大”“减小”或“不改变”)。
2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动 (填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH (填“增大”“减小”或“不改变”)。
⑵在25℃下,将aL,0.01mol·L-1的氨水加入到1L,0.01mol·L-1的盐酸溶液中,若反应后溶液中c(NH4+)>c(Cl-),则溶液显____性(填“酸”“碱”或“中”)。若a>1,反应所得溶液中下列离子浓度比较可能正确的是
①Cl->H+>NH4+>OH-;②Cl->NH4+>H+>OH-;③Cl-=NH4+>H+=OH-;④NH4+>Cl->OH->H+
⑶在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生
成_______沉淀(填化学式),生成该沉淀的离子方程式为_________________________;继
续滴加氨水,最后一步发生的反应的离子反应方程式
参考数据:25℃,Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
⑷有人设想寻求合适的催化剂和电极材料,以N2和H2为电极反应物,以HCl-NH4Cl为电
解质溶液环境制备新型燃料电池。则该燃料电池负极附近的pH____(填“增大”、“减小”或“不变”);正极的电极反应方程式为________ _____
常温下,浓度均为0.1 mol/L的四种溶液:
①Na2CO3溶液 NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 ;
(2)比较①、②溶液,PH值较大的是 ;
(3)在溶液④中加入少量NH4Cl固体,此时![]() 的值将 (填“变小”,“变大”或“不变”);
的值将 (填“变小”,“变大”或“不变”);
(4)用溶液③滴定V mL溶液④,其滴定曲线如右图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点:
水的电离程度最大的是 点,理由是;
;
②a点溶液中离子浓度大小关系是 ;
③取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,离子浓度大小关系是 。
运用化学反应原理研究氮、氧、镁、铜等元素及其化合物的性质。 ⑴合成氨反应反应:N2(g)+3H2(g)
⑴合成氨反应反应:N2(g)+3H2(g) 2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动 (填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH (填“增大”“减小”或“不改变”)。
2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动 (填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH (填“增大”“减小”或“不改变”)。 ⑵在25℃下,将aL,0.01mol·L-1的氨水加入到1L,0.01mol·L-1的盐酸溶液中,若反应后溶液中c(NH4+)>c(Cl-),则溶液显____性(填“酸”“碱”或“中”)。若a>1,反应所得溶液中下列离子浓度比较可能正确的是
⑵在25℃下,将aL,0.01mol·L-1的氨水加入到1L,0.01mol·L-1的盐酸溶液中,若反应后溶液中c(NH4+)>c(Cl-),则溶液显____性(填“酸”“碱”或“中”)。若a>1,反应所得溶液中下列离子浓度比较可能正确的是
①Cl->H+>NH4+>OH-;②Cl->NH4+>H+>OH-;③Cl-=NH4+>H+=OH-;④NH4+>Cl->OH->H+ ⑶在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生
⑶在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生
成_______沉淀(填化学式),生成该沉淀的离子方程式为_________________________;继
续滴加氨水,最后一步发生的反应的离子反应方程式
参考数据:25℃,Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
⑷有人设想寻求合适的催化剂和电极材料,以N2和H2为电极反应物,以HCl-NH4Cl为电
解质溶液环境制备新型燃料电池。则该燃料电池负极附近的pH____(填“增大”、“减小”或“不变”);正极的电极反应方程式为________ _____
常温下,浓度均为0.1 mol/L的四种溶液:
①Na2CO3溶液 NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 ;
(2)比较①、②溶液,PH值较大的是 ;
(3)在溶液④中加入少量NH4Cl固体,此时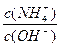 的值将 (填“变小”,“变大”或“不变”);
的值将 (填“变小”,“变大”或“不变”);
(4)用溶液③滴定V mL溶液④,其滴定曲线如右图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点:
水的电离程度最大的是 点,理由是;
;
②a点溶液中离子浓度大小关系是 ;
③取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,离子浓度大小关系是 。
运用化学反应原理研究氮、氧、镁、铜等元素及其化合物的性质。
⑴合成氨反应反应:N2(g)+3H2(g) 2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动 (填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH (填“增大”“减小”或“不改变”)。
2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动 (填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH (填“增大”“减小”或“不改变”)。
 ⑵在25℃下,将aL,0.01mol·L-1的氨水加入到1L,0.01mol·L-1的盐酸溶液中,若反应后溶液中c(NH4+)>c(Cl-),则溶液显____性(填“酸”“碱”或“中”)。若a>1,反应所得溶液中下列离子浓度比较可能正确的是
⑵在25℃下,将aL,0.01mol·L-1的氨水加入到1L,0.01mol·L-1的盐酸溶液中,若反应后溶液中c(NH4+)>c(Cl-),则溶液显____性(填“酸”“碱”或“中”)。若a>1,反应所得溶液中下列离子浓度比较可能正确的是
①Cl->H+>NH4+>OH-;②Cl->NH4+>H+>OH-;③Cl-=NH4+>H+=OH-;④NH4+>Cl->OH->H+
⑶在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生
成_______沉淀(填化学式),生成该沉淀的离子方程式为_________________________;继
续滴加氨水,最后一步发生的反应的离子反应方程式
参考数据:25℃,Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
⑷有人设想寻求合适的催化剂和电极材料,以N2和H2为电极反应物,以HCl-NH4Cl为电
解质溶液环境制备新型燃料电池。则该燃料电池负极附近的pH____(填“增大”、“减小”或“不变”);正极的电极反应方程式为________ _____
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com