(2011?南开区二模)工业生产纯碱的工艺流程示意图如下所示,其中向粗盐水中加入的沉淀剂A、B分别为氧化钙和碳酸钠.
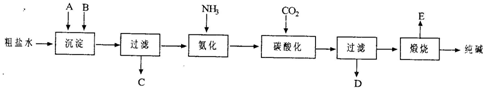
请回答下列问题:
(1)实验室提纯粗盐的实验操作依次为:
取样、
溶解
溶解
、沉淀、过滤、
蒸发
蒸发
、冷却结晶、过滤、烘干.
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
液面高于滤纸边缘或滤纸破了
液面高于滤纸边缘或滤纸破了
.
(2)实验室中,用提纯得到的NaCl配制500mL 1.00mol.L
-1NaCl溶液,使用的仪器除药匙、玻璃棒、量筒外,还需要
托盘天平、烧杯、500ml的容量瓶、胶头滴管
托盘天平、烧杯、500ml的容量瓶、胶头滴管
(填仪器名称).
(3)生产纯碱的工艺流程中,碳酸化时析出NaHCO
3晶体,没有析出Na
2CO
3晶体的原因是
NaHCO3的溶解度小于Na2CO3
NaHCO3的溶解度小于Na2CO3
.碳酸化后过滤,滤液D最主要的成分是(写化学式)
NH4Cl
NH4Cl
,检验这一部分的阴离子的具体方法是
取少量滤液,先加硝酸酸化,再滴加硝酸银溶液,有白色沉淀,该阴离子是氯离子;
取少量滤液,先加硝酸酸化,再滴加硝酸银溶液,有白色沉淀,该阴离子是氯离子;
.
(4)本工艺流程中氨是循环使用的,为此,向滤液D中加入石灰水产生氨.写出该反应的离子方程式
.
(5)产品纯碱中含有碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为(请注明你的表达式中所用的有关符号的含义):
.


 滤液
滤液 滤渣
滤渣 纯碱
纯碱
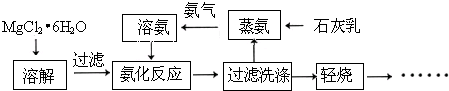

 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O Mg2++2OH-,在氯化铵溶液中存在NH4+:NH4++OH-
Mg2++2OH-,在氯化铵溶液中存在NH4+:NH4++OH- NH3?H2O
NH3?H2O NH3↑+H2O,滴加NH4Cl溶液,振荡使氨气快速逸出,均能使平衡正向移动,导致Mg(OH)2沉淀溶解
NH3↑+H2O,滴加NH4Cl溶液,振荡使氨气快速逸出,均能使平衡正向移动,导致Mg(OH)2沉淀溶解 Mg2++2OH-,在氯化铵溶液中存在NH4+:NH4++OH-
Mg2++2OH-,在氯化铵溶液中存在NH4+:NH4++OH- NH3?H2O
NH3?H2O NH3↑+H2O,滴加NH4Cl溶液,振荡使氨气快速逸出,均能使平衡正向移动,导致Mg(OH)2沉淀溶解
NH3↑+H2O,滴加NH4Cl溶液,振荡使氨气快速逸出,均能使平衡正向移动,导致Mg(OH)2沉淀溶解