
题目列表(包括答案和解析)
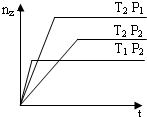 反应 2X(气)+Y(气)?2Z(气)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应 2X(气)+Y(气)?2Z(气)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )①2X+O2====2M ②2Y+O2====2Q ③2Z+O2====2R
上述方程式中除氧气外的其他物质均为氧化物,且通常状况下X、Y、Z都是气体,请根据要求回答问题:
(1)如果反应①在常温常压下即可顺利进行,则M的化学式是________________。
(2)如果反应②是一个燃烧反应,则Q的电子式是________,其分子为________(填“极性分子”或“非极性分子”)。
(3)如果反应③需在催化剂存在并加热条件下进行,则Z的化学式是____________,其固体的晶体类型为________________。
Ⅱ.(4)将6.2 g Na2O在干燥而充足的氧气中加热,充分反应;冷却后称量,固体质量为7.8 g,则该反应(反应④)的化学方程式为______________________________________。
(5)取43.2 g FeO在空气中充分加热,冷却后称量发现质量增加3.2 g,则该反应(反应⑤)的化学方程式为_______________________________________________________________。
Ⅲ.(6)反应①—⑤是氧化还原反应,但其中一个的化合价升降与另外四个有明显不同,请你找出这个反应:________________(填序号),你做此选择的理由是_________________。
反应2X(气)+Y(气)![]() 2Z(气)(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。下列判断正确的是( )
2Z(气)(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。下列判断正确的是( )
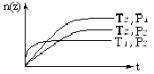
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
反应2X(气)+Y(气)![]() 2Z(气)(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。下列判断正确的是( )
2Z(气)(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。下列判断正确的是( )
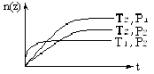
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
①2X+O2=
上述方程式中除氧气外的其他物质均为氧化物,且通常状况下X、Y、Z都是气体,请根据要求回答问题:
(1)如果反应①在常温常压下即可顺利进行,则M的化学式是__________________________。
(2)如果反应②是一个燃烧反应,则Q的电子式是____________________,其分子为_________ (填“极性分子”或“非极性分子”)。
(3)如果反应③需在催化剂存在并加热条件下进行,则Z的化学式是___________________,其固体的晶体类型为_________。
Ⅱ.(4)将
(5)取
Ⅲ.(6)反应①—⑤是氧化还原反应,但其中一个的化合价升降与另外四个有明显不同,请你找出这个反应:_________ (填序号),你作此选择的理由是___________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com