
题目列表(包括答案和解析)
 Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.
Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
|
阴离子 |
SO42-、NO3-、Cl- |
|
阳离子 |
Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
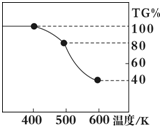
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:

(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为 。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为: ;释放第二种气体时,反应的化学方程式为 。
三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究.实验装置图如下:

限选试剂:
浓H2SO4、、1.0 mo1·L-1 H2SO4、1.0 mo1·L-1 HNO3、1.0 mo1·L-1 NaOH、3%H2O2、1.0 mol·L-1 CuSO4、20% KSCN、饱和澄清石灰水、蒸馏水、0.1%酸性高锰酸钾溶液.
(1)实验时观察到:C试管中饱和澄清石灰水变浑浊,E试管中盛浓H2SO4,从E试管流出的气体被点燃,则气体产物是________.D试管中应盛有________溶液,其作用是:________________.
(2)固体产物中有钾盐和含铁元素的物质.该小组同学查阅资料后推知固体产物中铁元素无正三价形式,并对固体产物中铁元素存在形式进行了探究.实验过程如下:①取适量固体产物于试管中,加入足量蒸馏水,充分振荡.过滤取出不溶性固体,用蒸馏水充分洗涤.②向试管中加入少量上述不溶固体,加入过量CuSO4溶液,充分振荡.溶液的蓝色明显变浅,且有暗红色固体物质生成.③过滤取出暗红色不溶性固体,用蒸馏水洗涤至洗涤液无色.取少量该固体于试管中,加过量1.0 mol·L-1·H2SO4后,静置,取上层清液少许于试管中,滴加适量3% H2O2溶液,充分振荡后滴加20% KSCN溶液,发现溶液呈红色.
以上实验证明固体产物中铁元素的存在形式为:________.
(3)请你对固体产物中钾盐的成分进行探究.
①提出合理假设
假设1:全部为________(写化学式)
假设2:全部为K2C2O4
假设3:为以上二者的混合物.
②设计实验方案证明你的假设(不用作答)
③实验过程
根据②中方案进行实验.完成下表实验步骤、现象与结论.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com