
题目列表(包括答案和解析)
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:
①![]() ②
②![]() ③
③![]() ……
……
反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属于 键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是 (用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
b.卤化氢的键长按H―F、H―C1、H―Br、H―I的顺序依次减小
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按![]() 、
、![]() 、
、![]() 、
、![]() 的顺序由难变易
的顺序由难变易
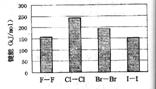
 (4)卤素单质的键能大小如右图。由图推断:
(4)卤素单质的键能大小如右图。由图推断:
①非金属性强的卤素,其单质分子的化学键 断裂(填“容易”或“不容易”或“不一定容易”)。
②卤素单质键能大小与键长的关系为:
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
![]() (1)在光照条件下,氯气和氢气反应过程如下:
(1)在光照条件下,氯气和氢气反应过程如下:
![]() ①
①![]() ②
②![]() ③
③![]() ……
……
![]() 反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属
反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属
![]() 于 键(填“极性”或“非极性”)。
于 键(填“极性”或“非极性”)。
![]() (2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
![]() (用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
![]() (3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
![]() a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
![]() b.卤化氢的键长按H―F、H―C1、H―Br、H―I的顺序依次减小
b.卤化氢的键长按H―F、H―C1、H―Br、H―I的顺序依次减小
![]() c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
![]() d.卤素单质与氢气化合按
d.卤素单质与氢气化合按![]() 、
、![]() 、
、![]() 、
、![]() 的顺序由难变易
的顺序由难变易
![]() (4)卤素单质的键能大小如右图。由图推断:
(4)卤素单质的键能大小如右图。由图推断:
![]() ①非金属性强的卤素,其单质分子的化学键
①非金属性强的卤素,其单质分子的化学键
![]() 断裂(填“容易”或“不容易”或“不一定容易”)。
断裂(填“容易”或“不容易”或“不一定容易”)。
![]() ②卤素单质键能大小与键长的关系为:
②卤素单质键能大小与键长的关系为:
![]()
![]()
![]()
 ②
② ③
③ …… 反应②中形成的化合物的电子式为_________________;反应③中被破坏的化学键属于__________________键(填“极性”或“非极性”)。
…… 反应②中形成的化合物的电子式为_________________;反应③中被破坏的化学键属于__________________键(填“极性”或“非极性”)。(14分)高纯六水氯化锶(SrCl2·6H2O)可用于制造高档磁性材料、电解金属钠的助熔剂、高档颜料和液晶玻璃等,具有很高的经济价值。高纯六水氯化锶的制备过程如下:
Ⅰ.将纯水加入烧杯内,搅拌下加入适量工业碳酸锶粉末(含少量Ba、Fe的化合物),制成浆料。
Ⅱ.缓慢加入工业盐酸进行酸化,将固体物质溶解。
Ⅲ.然后喷淋加入适量的硫酸,再加入质量分数为30%的双氧水少许。
Ⅳ.调节pH至8~10, 加热至60~70℃, ,搅拌1h,过滤,除去残渣。
Ⅴ.滤液加热至沸,继续浓缩至氯化锶质量浓度(溶质质量与溶液体积之比)为x g/L。
请回答:
(1)用电子式表示HCl的形成过程 。
(2)已知Sr为第五周期第ⅡA族元素,则不符合Sr>Ca的是 (填序号)。
① 原子半径 ② 最外层电子数
③ 金属性 ④ 最高价氧化物对应的水化物的碱性
(3)写出步骤Ⅱ中加入盐酸时发生反应的离子方程式: 。
(4)加入硫酸后会先生成硫酸锶沉淀,进而转化为硫酸钡沉淀,试分析原理 。
(5)步骤Ⅲ中在酸性环境下加入双氧水是为将亚铁离子氧化成铁离子,写出该反应的离子方程式: 。
(6)步骤Ⅳ中调节pH至8~10,最好选用的试剂为 。
(7)已知某次实验得到浓缩后的氯化锶溶液中溶质为818g,溶剂为1000 g,经测定该溶液的密度为1.5g/mL,则该溶液溶质的质量浓度x为 g/L(计算结果保留整数) 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com