
题目列表(包括答案和解析)
下列叙述正确的是( )
A.48gO3气体含有6.02×1023个O3分子
B.常温常压下,4.6gNO2气体含有1.81×1023个NO2分子
C.0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6LH2O含有9.03×1023个H2O分子
【解析】解题时要注意回忆概念、分析原理注意运算公式的适用范围。B选项4.6gNO2气体中理论上含有1mol NO2分子,约6.02×1023个NO2分子,由于2NO2 N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
下列叙述正确的是( )
A.48gO3气体含有6.02×1023个O3分子
B.常温常压下,4.6gNO2气体含有1.81×1023个NO2分子
C.0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6LH2O含有9.03×1023个H2O分子
【解析】解题时要注意回忆概念、分析原理注意运算公式的适用范围。B选项4.6gNO2气体中理论上含有1mol NO2分子,约6.02×1023个NO2分子,由于2NO2 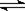 N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com