
题目列表(包括答案和解析)
 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.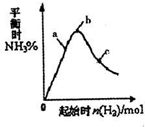 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.| 1 | 2 |
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。
(1)火箭常用N2H4作燃料,N2O4作氧化剂。已知:
N2(g) + 2O2(g) =2NO2(g) △H = +67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)  1/2N2O4(g)
△H = -26.35 kJ·mol-1
1/2N2O4(g)
△H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
。
 (2)联氨——空气燃料电池是一种碱性燃料电池,电
(2)联氨——空气燃料电池是一种碱性燃料电池,电
解质溶液是20%~30%的氢氧化钾溶液。该电
池放电时,正极的电极反应式为 。
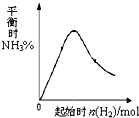
(3)在300℃时,改变起始反应物中氢气的物质的量
对反应N2(g) + 3H2(g)  2NH3(g) △H<0
2NH3(g) △H<0
的影响如右图所示。
①请在图中画出400℃时对应的图像。
②在a、b、c三点中,H2 的转化率最高的是 (填字母)。
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com