
题目列表(包括答案和解析)
|
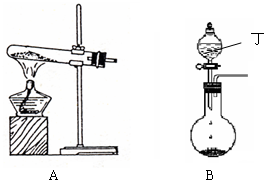
将a g下列物质在足量的氧气中完全燃烧,再将产生的气体通过足量的Na2O2固体,充分反应后,固体增加的质量大于a g的是: | |
| [ ] | |
A. |
CO 和H2 |
B. |
C6H12O6 |
C. |
CH2O2 |
D. |
C2H5OH |
| ||
| ||
| ||
| ||
| 实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
| 取少量晶体于试管中,充分加热 | 试管内有固体剩余 | 该晶体不是NH4HCO3 该晶体不是NH4HCO3 |
无离子方程式 无离子方程式 |
向冷却后试管中加入足量盐酸 向冷却后试管中加入足量盐酸 |
固体全部溶解,有气泡产生 | 该晶体不是NaCl是NaHCO3 该晶体不是NaCl是NaHCO3 |
CO32-+2H+=H2O+CO2↑ CO32-+2H+=H2O+CO2↑ |

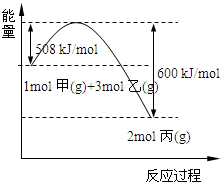
| 9n |
| 4m |
| 9n |
| 4m |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com