
题目列表(包括答案和解析)
|
在下图所示的装置中,干燥的烧瓶中充有某种气体,烧杯和滴管内盛放同种溶液.挤压滴管的胶头,即可出现美丽的喷泉.所选试剂与实验事实不相符的是
| |
| [ ] | |
A. |
CO2(NaHCO3溶液)无色喷泉 |
B. |
NH3(H2O含酚酞)红色喷泉 |
C. |
H2S(CuSO4溶液)黑色喷泉 |
D. |
HCl(AgNO3溶液)白色喷泉 |
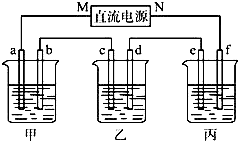 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.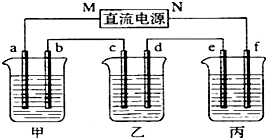
| ||
| ||
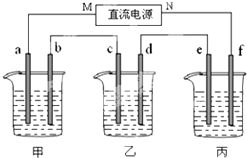 如图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题:
如图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题:. 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极。

接通电源,经过一段时间后,测得乙中c电极质量增加了16g。据此回答下列问题:
(1)电极b上发生的电极反应为 ;
(2)计算电极e上生成的气体在标准状态下的体积: ;
(3)电解后甲溶液的pH (填“增大”、“减小”或“不变”) ,简述其原因: ;
(4)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com