
题目列表(包括答案和解析)
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
|
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O ![]() 2CrO42- + 2H+
2CrO42- + 2H+
请回答:
(1)生成滤渣1中红褐色物质的反应的化学方程式是 。
滤液1的成分除Na2CrO4外,还含有(填化学式) 。
(2)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是 。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是 。
(4)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、 、 、洗涤、干燥。
(5)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是
。
某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。

请回答:
(1)由I可知X中一定存在的是 ,步骤I所发生反应的离子方程式为: 、 。
(2)反应II的化学方程式是 。
为进一步确定上述混合物X的成分,另取9.4gX进行如下实验。

(3)由Ⅲ可得出的结论为: 。
(4)步骤Ⅳ所得蓝色溶液中阳离子为 。
(5)原混合物中各成分的质量之比是 。(不必化简)
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。(已知:碳酸不能溶解Al(OH)3沉淀)

(1)用滤渣制备粗硅的化学反应方程式为
(2)下列说法正确的是
a.酸性:H2CO3>H2SiO3 b.结合质子的能力:CO![]() > AlO2->HCO3-
> AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4 d.离子半径:O2-<Al3+
(3)滤渣和NaOH溶液反应的离子方程式是
通过 现象说明此矿山中不含Al2O3
(4)该矿石和稀HNO3发生氧化还原反应的离子方程式为
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,主要两个目的是 , ;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg ,理论上至少需要1 molL-1 HNO3的体积为 L。
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是 。
(2)滤渣A的成分是 。
(3)滤液B中TiOCl42- 转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如 下图所示。反应温度过高时,Ti元素浸出率下降的原因是 。
(5)反应③的化学方程式是 。

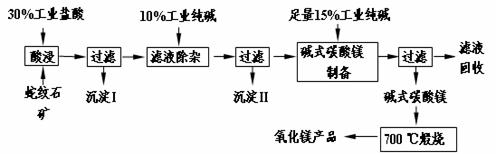
蛇纹石因其花纹似蛇皮而得名,某地蛇纹石大约含MgO38%,另外除了含SiO2外,还含有CaO、Fe2O3、Al2O3等氧化物,由蛇纹石矿制备MgO的工艺流程如下。
(1)写出酸浸过程中的一个离子方程式 。若在实验室进行酸浸过程,需要的仪器有烧杯、 。
(2)沉淀I的成分是 (写化学式)。写出它的一个用途 。
(3)沉淀II的成分是 。
(4)从滤液中能回收的物质有 。
(5)写出碱式碳酸镁700 ℃煅烧产生氧化镁的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com