
题目列表(包括答案和解析)
| |||||||||||||||||||||||||
(5分)为提纯含有少量CaCl2、KBr杂质的KCl,某课外活动小组的同学设计了以下实验方案。
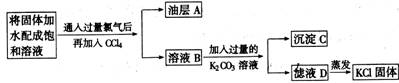
就此实验回答下列问题:
(1)A中的溶质是____,分离A与B所用的主要仪器是_________。
(2)C的化学式是____。
(3)蒸发D得到的固体仍含有______杂质,要得到较纯净的KCl,必须向D中加入_____后再进行蒸发。
(10分)设反应①![]() 的平衡常数为K1,
的平衡常数为K1,
反应②![]() 的平衡常数为K2,
的平衡常数为K2,
测得在不同温度下,K1、K2的数值如下:

(l)若5000C时进行反应①,CO2起始浓度为2.00 mo I?L-1,则CO2转化率为_。
(2)9000C时进行反应③C02(g)+H2(g)![]() CO(g)+H20(g),其平衡常数K3数值为_。
CO(g)+H20(g),其平衡常数K3数值为_。
(3)反应②的焙变∆H____ 0(填“>”或“<”或“一”)
(4)700℃时反应②达到平衡,要使该平衡向右移动,当其他条件不变时,可采取的措施有______(填序号)。
A.缩小反应容器容积 B.加入更多的水蒸汽
C.升高温度到9000C D.使用合适的催化剂
(5)下列图像符合反应①的是_(填图像序一号)(图中v为速率,笋为混合气中CO的百分含量,T为温度)。

使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)配制100 mL待测白醋溶液。量取10.00 mL市售白醋,注入烧杯中用水稀释后转移到 (填仪器名称)中定容,摇匀即得。
(2)用 量取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2
___________作指示剂。
(3)读取盛装0.100 0 mol·L-1 NaOH溶液的 (填仪器名称)的初始读数。如果液面位置下图所示,则此时的读数为 mL。
(4)滴定。滴定过程中,眼睛应观察 。滴定终点后记录NaOH溶液的终点读数。再重复滴定3次。
Ⅱ.实验记录:
| 滴定次数 实验数据/mL |
1 |
2 |
3 |
4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=[(15.95+15.00+15.05+14.95)/4] mL=15.24mL。
指出他的计算的不合理之处:______________________________________。
按正确数据处理,可得c(市售白醋)=___________mol·L-1;市售白醋总酸量=_________g/100 mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_______ (填写序号)。
a.未用标准NaOH溶液润洗滴定管
b.锥形瓶中加入待测白醋溶液后,再加少量水
c.锥形瓶在滴定时剧烈摇动,有少量液体溅出
d.滴定前锥形瓶用待测白醋溶液润洗
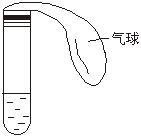
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是______溶液;加热时溶液由红色逐渐变浅的原因是:_________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是______溶液;加热时溶液由无色变为红色的原因是:_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com