
题目列表(包括答案和解析)
 将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)| 催化剂 |
| |||||||||||||||||
| |||||||||||||||||||
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1) 新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,其吸收的化学反应方程式为 再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(2) 工业上生产硫酸时,将SO2氧化为SO3是关键一步。
① 某温度下,SO2(g)+1/2O2(g)![]() SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K= 。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K= 。
② 一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
A、保持温度和容器压强不变,充入2mol SO3
B、保持温度和容器体积不变,充入2mol N2
C、保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D、升高温度
E、移动活塞压缩气体
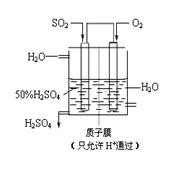
(3) 某人设想以如图所示装置用电化学原理生产硫酸,通入O2的一极的电极为 极; 写出通入SO2的电极的电极反应式: 。
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1) 新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,其吸收的化学反应方程式为 再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(2) 工业上生产硫酸时,将SO2氧化为SO3是关键一步。
① 某温度下,SO2(g)+1/2O2(g)![]() SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K= 。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K= 。
② 一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
A、保持温度和容器压强不变,充入2mol SO3
B、保持温度和容器体积不变,充入2mol N2
C、保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D、升高温度
E、移动活塞压缩气体
(3) 某人设想以如图所示装置用电化学原理生产硫酸,通入O2的一极的电极为 极; 写出通入SO2的电极的电极反应式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com