
题目列表(包括答案和解析)
(9分)在一有有色气体参加的可逆反应中,体系的颜色变化往往用来说明平衡的建立或平衡的移动,而对这种颜色变化的观察又受到观察角度及操作过程的不同而有所变化。如图所示,在一定温度、压强下,在透明的玻璃圆筒中装入NO2、N2O4的混合气体100ml,并使可逆反应2NO2 N2O4达到平衡。(注意:视线b是一圆截面,颜色深浅可以看成有色分子在截面上的投影的密度大小)
N2O4达到平衡。(注意:视线b是一圆截面,颜色深浅可以看成有色分子在截面上的投影的密度大小)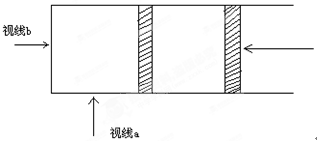
⑴将混合气体突然压缩至50mL则通过视线a方向观察到的平衡体系的颜色变化是____________。而由视线b方向观察到的平衡体系的颜色变化是________________。说明造成从a、b 不同方向观察的颜色变化趋势不同的原因是_________________________________________________________。
⑵将混合气体缓缓压缩至50mL,则由视线a方向观察到的颜色变化为________________________-。
⑶上述气体采用上述两种不同的压缩方法,都于相同温度和50mL体积的状态下达到平衡,则此时平衡体系的平均分子量M1和M2的关系为_______________-。气体颜色___________________(填“相同”或“不同”)
⑷在相同温度、压强下,若容器起初只装入N2O4,达平衡后,重复上述实验,现象是否相同____________。
⑸在NO2生成N2O4的可逆反应里,逆反应是 (填吸热、放热)反应:2NO2 (g) N2O4(g) ,压缩时该平衡体系向环境 (吸收、放出)热量。
(9分)在一有有色气体参加的可逆反应中,体系的颜色变化往往用来说明平衡的建立或平衡的移动,而对这种颜色变化的观察又受到观察角度及操作过程的不同而有所变化。如图所示,在一定温度、压强下,在透明的玻璃圆筒中装入NO2、N2O4的混合气体100ml,并使可逆反应2NO2N2O4达到平衡。(注意:视线b是一圆截面,颜色深浅可以看成有色分子在截面上的投影的密度大小)
(1) 将混合气体突然压缩至50mL则通过视线a方向观察到的平衡体系的颜色变化是____________。而由视线b方向观察到的平衡体系的颜色变化是________________。说明造成从a、b 不同方向观察的颜色变化趋势不同的原因是_________________________________________________________。
(2) 将混合气体缓缓压缩至50mL,则由视线a方向观察到的颜色变化为________________________-。
(3) 上述气体采用上述两种不同的压缩方法,都于相同温度和50mL体积的状态下达到平衡,则此时平衡体系的平均分子量M1和M2的关系为_______________-。气体颜色___________________(填“相同”或“不同”)
(4) 在相同温度、压强下,若容器起初只装入N2O4,达平衡后,重复上述实验,现象是否相同____________。
在NO2 生成N2O4 的可逆反应里,逆反应是 (填吸热、放热)反应:2NO2 (g) N2O4(g) ,压缩时该平衡体系向环境 (吸收、放出)热量。
(9分)在一有有色气体参加的可逆反应中,体系的颜色变化往往用来说明平衡的建立或平衡的移动,而对这种颜色变化的观察又受到观察角度及操作过程的不同而有所变化。如图所示,在一定温度、压强下,在透明的玻璃圆筒中装入NO2、N2O4的混合气体100ml,并使可逆反应2NO2 N2O4达到平衡。(注意:视线b是一圆截面,颜色深浅可以看成有色分子在截面上的投影的密度大小)
N2O4达到平衡。(注意:视线b是一圆截面,颜色深浅可以看成有色分子在截面上的投影的密度大小)

(1) 将混合气体突然压缩至50mL则通过视线a方向观察到的平衡体系的颜色变化是____________。而由视线b方向观察到的平衡体系的颜色变化是________________。说明造成从a、b 不同方向观察的颜色变化趋势不同的原因是_________________________________________________________。
(2) 将混合气体缓缓压缩至50mL,则由视线a方向观察到的颜色变化为________________________-。
(3) 上述气体采用上述两种不同的压缩方法,都于相同温度和50mL体积的状态下达到平衡,则此时平衡体系的平均分子量M1和M2的关系为_______________-。气体颜色___________________(填“相同”或“不同”)
(4) 在相同温度、压强下,若容器起初只装入N2O4,达平衡后,重复上述实验,现象是否相同____________。
在NO2 生成N2O4 的可逆反应里,逆反应是 (填吸热、放热)反应:2NO2 (g)  N2O4(g) ,压缩时该平衡体系向环境
(吸收、放出)热量。
N2O4(g) ,压缩时该平衡体系向环境
(吸收、放出)热量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com