
题目列表(包括答案和解析)
氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题:
(1)写出氨气与氧化铜反应的化学方程式: 。
(2)在A的锥形瓶中放入NaOH固体的目的是 。
(3)在干燥管B中不能选用的干燥剂是 (填序号);
A.碱石灰 B.生石灰 C.五氧化二磷 D.氢氧化钠
(4)E装置中盛装浓硫酸的目的是: ;
(5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
(6)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集NH3
①在图中方框内画出用烧瓶收集甲的仪器装置简图.
②烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题: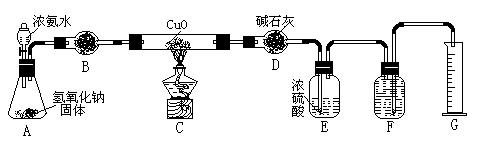
(1)写出氨气与氧化铜反应的化学方程式: 。
(2)在A的锥形瓶中放入NaOH固体的目的是 。
(3)在干燥管B中不能选用的干燥剂是 (填序号);
| A.碱石灰 | B.生石灰 | C.五氧化二磷 | D.氢氧化钠 |
 5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。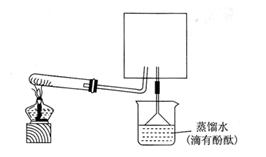
 。
。氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题:
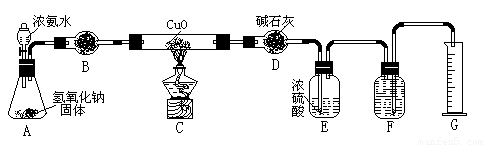
(1)写出氨气与氧化铜反应的化学方程式: 。
(2)在A的锥形瓶中放入NaOH固体的目的是 。
(3)在干燥管B中不能选用的干燥剂是 (填序号);
A.碱石灰 B.生石灰 C.五氧化二磷 D.氢氧化钠
(4)E装置中盛装浓硫酸的目的是: ;
(5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
(6)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集NH3
①在图中方框内画出用烧瓶收集甲的仪器装置简图.
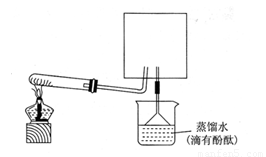
②烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
请解释下列生产生活中的化学问题:
(1)碳酸氢钠是常见的疏松剂,用化学方程式表示其疏松作用的原理_________________。
(2)抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
①写出该抗酸药发挥功效时的离子方程式:
、 。
②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写化学式) 。
(3)已知1g葡萄糖氧化成二氧化碳和液态水时放出的热量为15.57kJ ,写出葡萄糖在人体内转化的热化学方程式: 。
(4)羟基磷酸钙[Ca5(PO4)3OH]是牙齿表面的一层坚硬物质,它可保护牙齿,它在唾液中存在如下平衡:
Ca5(PO4)3OH(s)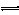 5Ca2+ + 3PO43―+ OH―
5Ca2+ + 3PO43―+ OH―
进食后,细菌和酶作用于食物产生有机酸,这时牙齿会受到腐蚀,其原因是 ;
已知氟磷酸钙[Ca5(PO4)3F]的溶解度比上面的羟基磷酸钙更小,请用离子方程式表示当牙膏中含有氟化物后,能防止龋齿的原因 ;
根据以上原理,请你提出一种其他促进牙齿坚固的方法磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
(1)磷元素原子核外最外层电子排布式为 。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 。
(2)氧原子核外有 种不同能量的电子。
(3)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式 。
(4)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。
(5)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。
(6)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+ 。请完成并配平上述反应离子方程式。该反应的还原产物是__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com