
题目列表(包括答案和解析)
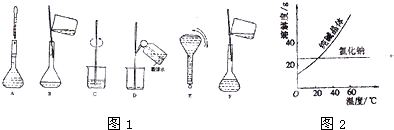
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 | 乙二醇C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 | 丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) 在容积固定的恒温密闭容器中充入NH3和O2发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) 在容积固定的恒温密闭容器中充入NH3和O2发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | c(O2 )(mol/L) | c(NO)(mol/L) |
| 起始 | 0.800 | 1.000 | 0.000 |
| 第2 min | a | b | c |
| 第4 min | 0.400 | 0. 500 |
(1)下列能说明该反应已经达到平衡状态的是 ▲ (1分) ;
A.容器中气体平均摩尔质量不变 B.c(O2)不变 C.v(O2)= 1.25v(NH3) D.体系气体无颜色变化 E.体系压强不变
(2) 在容器中加入正催化剂,则反应速率 ▲ (填“增大”“减小”“不变”;后同),降低容器的温度则反应速率 ▲ (各1分)。
(3)反应在第2 min时,容器中压强与反应前之比为19︰18则a= ▲ mol/L;0~2 min平均速率v(NH3)= ▲ 。第4 min时反应 ▲ (是、否)达到平衡(各1分)
(4)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因可能 ▲ (1分)。
(5)如果把该反应设计为原电池,NH3在原电池 ▲ 极,电解质溶液中阴离子向 ▲ 极移动(各1分)。若果以NaCl为电解质,正极反应为:
▲ (2分)
已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在容积固定的恒温密闭容器中充入NH3和O2发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g)在容积固定的恒温密闭容器中充入NH3和O2发生上述反应,容器内部分物质的物质的量浓度如下表:

(1)下列能说明该反应已经达到平衡状态的是________;
A.容器中气体平均摩尔质量不变
B.c(O2)不变
C.v(O2)=1.25v(NH3)
D.体系气体无颜色变化
E.体系压强不变
(2)在容器中加入正催化剂,则反应速率________(填“增大”“减小”“不变”;后同),降低容器的温度则反应速率________.
(3)反应在第2 min时,容器中压强与反应前之比为19∶18则a=________mol/L;0~2 min平均速率v(NH3)=________.第4 min时反应________(是、否)达到平衡.
(4)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因可能________.
(5)如果把该反应设计为原电池,NH3在原电池________极,电解质溶液中阴离子向________极移动.若果以NaCl为电解质,正极反应为:________.
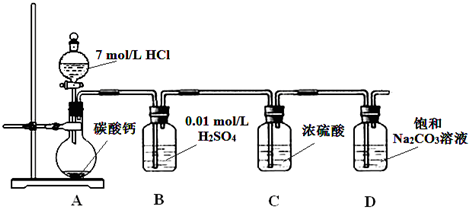
| 剩余固体的质量 | 原始固体的质量 |
在一次兴趣小组活动中,一小组利用物质间的互变,设计成一平面“魔方”如图所示。已知:
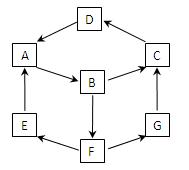
①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体;B与硝酸银溶液反
应生成不溶于稀硝酸的白色沉淀;B也能将一种能形成酸
雨的氧化物氧化为F,F是一种含氧酸,且F的稀溶液
能与A反应生成E和G。
| 物质 | 纯A(单质) | B(溶液) | D(固体) | G(溶液) |
| 颜色 | 银白色 | 黄色 | 红棕色 | 浅绿色 |
③几种物质的部分物理性质:
依据以上信息填空:
(1)G生成C的过程中所出现的现象为 ;
(2)写出下列反应的化学方程式:
A→B : ;
(3)写出下列反应的离子方程式:
B→F: ;
酸性条件下,G与次氯酸溶液反应: ;
(4)使一定质量的Zn与100mL18.5 mol·L-1 酸F的浓溶液充分反应,Zn完全溶解,同时生成标准状况下的气体A 33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol·L-1,则气体A的成份及体积比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com