
题目列表(包括答案和解析)
石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如右图所示,图中用虚线标出了石墨的一个六方晶胞。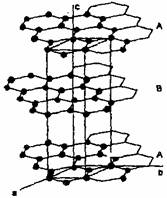
(1)该晶胞的碳原子个数 。
(2)写出晶胞内各碳的原子坐标。
(3)已知石墨的层间距为334.8 pm,C-C键长为142 pm,计算石墨晶体的密度为 。
 石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+x Li++x e-→ LiC6 其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+x Li++x e-→ LiC6 其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
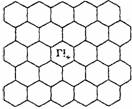
(4)右图给出了一个Li+沿C轴投影在A层上的位置,试在右图上标出与该离子临近的其他6个Li+的投影位置。
(5)在LiC6中,Li+与相邻石墨六元环的作用力属何种键型?
(6)某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式。
锂离子电池的正极材料为层状结构的LiNiO2。已知LiNiO2中Li+和Ni3+均处于氧离子组成的正八面体体心位置,但处于不同层中。
(7)将化学计量的NiO和LiOH在空气中加热到770℃可得LiNiO2,试写出反应方程式。
(8)写出LiNiO2正极的充电反应方程式。
(9)锂离子完全脱嵌时 LiNiO2 的层状结构会变得不稳定,用铝取代部分镍形成LiNi1-y Al y O2。可防止理离子完全脱嵌而起到稳定结构的作用,为什么?
| 高温 |
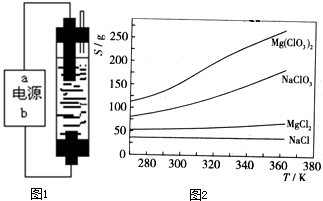
市场销售的某种食用精制盐包装袋上有如下说明:

(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+________KI+________H2SO4=________K2SO4+________I2+________H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是________.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是________;所缺步骤为________.
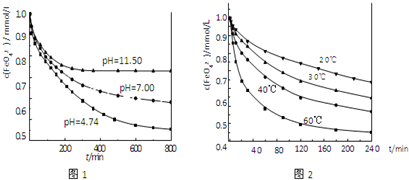
(3)已知:I2+2S2O32-![]() 2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取12.7 g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4 mol·L-1的Na2S2O3溶液20.0 mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是________.
②根据以上实验和包装袋说明,所测精制盐的碘含量是________mg/kg.
| ||
| ||
| ||
| ||
| ||
| ||
| O | 2- 4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com