
题目列表(包括答案和解析)
| 4CV2 |
| WV1 |
| 4CV2 |
| WV1 |

| 实验步骤 | 有关问题 |
| ①计算所需NaCl的质量 | |
| ②称量NaCl固体 | 用托盘天平需要称量NaCl的质量为 2.9 2.9 g. |
| ③将NaCl加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施: 用玻璃棒搅拌 用玻璃棒搅拌 . |
| ④将烧杯中溶液转移至250mL容量瓶中 | 为了防止溶液溅出,应采取什么措施: 用玻璃棒引流 用玻璃棒引流 . |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作: 改用胶头滴管加水至刻度线 改用胶头滴管加水至刻度线 . |
 实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题
实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题 如图为病人输液用的生理盐水(化学式为NaCl)注射液标签上的部分內容.(该注射液就是氯化钠的水溶液)试根据标签上的有关数据回答下列问题:
如图为病人输液用的生理盐水(化学式为NaCl)注射液标签上的部分內容.(该注射液就是氯化钠的水溶液)试根据标签上的有关数据回答下列问题:亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38oC时析出的晶体是NaClO2·3H2O,高于38oC时析出晶体是NaClO2,高于60oC时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。装置②反应容器为三颈烧瓶。
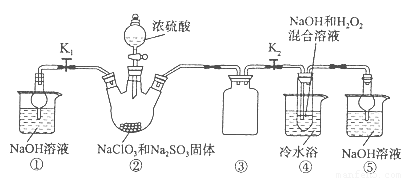
完成下列填空:
(1)组装好仪器后,检查整套装置气密性的操作是:??????????????????? 。
(2)装置②中产生ClO2的化学方程式为 ??????????????????????????????? 。
装置④中发生反应的离子方程式为????????????????????????????????? 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55oC蒸发结晶;②????? ;③????? ;④低于60oC干燥,得到成品。
(4)目前已开发出用电解法制取ClO2的新工艺。
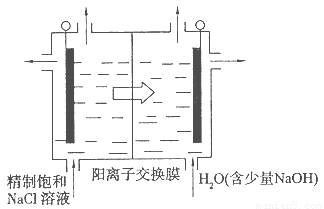
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生C1O2的电极反应为 ????????????? 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为??? mol。
(5)准确称取所得亚氯酸钠样品l0 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+=2H2O+2I2+C1-)。将所得混合液配成250 mL待测溶液。配制待测液需用到的定量玻璃仪器是????? ;取25.00 mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为?????????? 。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为???????? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com