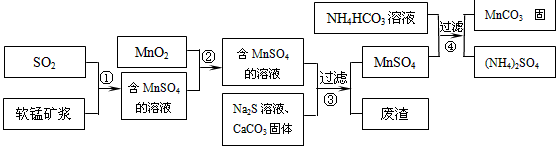
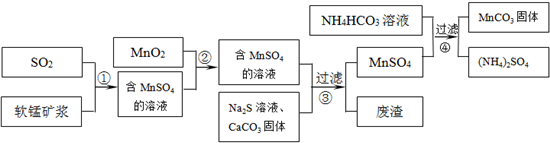
碳酸锰(MnCO
3)是理想的高性能强磁性材料,也是制备Mn
2O
3、MnO
2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO
3的生产流程如图所示.
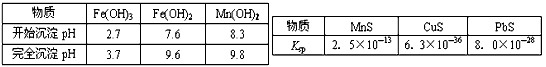
已知生成氢氧化物的pH和有关硫化物的K
sp如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
| 开始沉淀pH |
2.7 |
7.6 |
8.3 |
| 完全沉淀pH |
3.7 |
9.6 |
9.8 |
| 物质 |
MnS |
CuS |
PbS |
| Ksp |
2.5×10-13 |
6.3×10-36 |
8.0×10-28 |
软锰矿主要成分为MnO
2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO
2来自工业废气.流程①中主要发生的反应有:MnO
2+SO
2=MnSO
4 2Fe
3++SO
2+2H
2O=2Fe
2++SO
42-+4H
+.
(1)流程①中所得MnSO
4溶液的pH比软锰矿浆的pH______(填“大”或“小”),该流程可与______(填工业生产名称)联合,生产效益更高.
(2)反应②的目的是将溶液中的Fe
2+氧化成Fe
3+,其离子反应方程式为______,这样设计的目的和原理是______
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是______.
(4)反应④发生的化学反应为:MnSO
4+2NH
4HCO
3=MnCO
3↓+(NH
4)
2SO
4+CO
2↑+H
2O.
反应中通常需加入稍过量的NH
4HCO
3,且控制溶液的pH为6.8~7.4.加入稍过量的NH
4HCO
3的目的是______,溶液的pH不能过低的原因是______.
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO
2的工业废气反应 工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是______.(答对1个即可)