
题目列表(包括答案和解析)
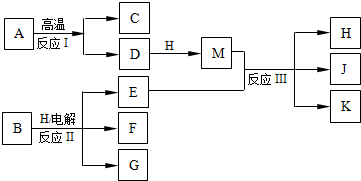
 现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下

| ||
| △ |
| ||
| △ |
| 实验操作 | 现象和结论 |
| 步骤一: | 若产生蓝色沉淀,则 |
| 步骤二: | 若乙醚层呈血红色,则 |


| ||
| ||

| 序号 | 实验内容要点 | 实验现象, | 结论及解释 | ||||
| (1) | 加热后,缓慢通气体 | E中澄清石灰水不变浑浊,G中澄清石灰水变浑浊 | 猜想 ① ① 成立 | ||||
| (2) | 将D装置取走,连接好其余装置, 继续反应 |
观察到E中澄清石灰水始终不 变浑浊 |
猜想 ⑦ ⑦ 不成立 | ||||
| (3) | 用pH试纸测C中混和物pH | pH试纸变为 浅红或是红 浅红或是红 色,pH=3 |
猜想④成立. | ||||
| (4) | 取C中适量混和液,滴加稍过量 碳酸氢钠溶液蒸馏,取馏出物 碳酸氢钠溶液蒸馏,取馏出物 ,再与银氨溶液反应 |
出现银镜 | 猜想③成立,银镜反应离子方程式为 HCHO+2[Ag(NH3)2]++2OH-
HCHO+2[Ag(NH3)2]++2OH-
| ||||
| … | … | … |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com