
题目列表(包括答案和解析)
(8分)锌铝合金的主要成分有Zn、Al、Cu、Si等元素。实验室测定其中Cu含量的步骤如下:①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于250mL容量瓶中。
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,用0.01100mol×L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2 + 2S2O32- = 2I- + S4O62-),消耗Na2S2O3溶液6.45mL。
⑴写出步骤①溶解Cu的离子方程式 。
⑵判断步骤②滴定终点的方法是 。
⑶计算合金中Cu的质量分数。
(8分)锌铝合金的主要成分有Zn、Al、Cu、Si等元素。实验室测定其中Cu含量的步骤如下:①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于250mL容量瓶中。
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,用0.01100mol×L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2 + 2S2O32- = 2I- + S4O62-),消耗Na2S2O3溶液6.45mL。
⑴写出步骤①溶解Cu的离子方程式 。
⑵判断步骤②滴定终点的方法是 。
⑶计算合金中Cu的质量分数。
 Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.
Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.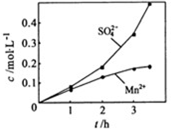
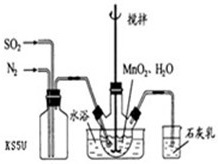
Ⅰ、高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
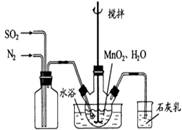
(1)制备MnSO4溶液:在烧瓶中(装置见图)加入一定量MnO2 和水,搅拌,通入 SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O)。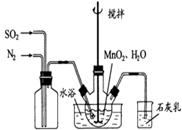
①石灰乳作用: 。
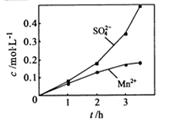
②若实验中将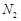 换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。
换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。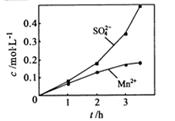
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH="7.7," 请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤:
[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
① ;
② ;
③检验SO42-是否被洗涤除去; ④用少量乙醇洗涤; ⑤低于100℃干燥。
Ⅱ、锌铝合金的主要成分有Zn、Al、Cu、Si等元素。实验室测定其中Cu含量的步骤如下:①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于250mL容量瓶中。
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,用0.01100mol×L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2 + 2S2O32- = 2I- + S4O62-),消耗Na2S2O3溶液6.45mL。
(1)判断步骤②滴定终点的方法是 。
(2)计算合金中Cu的质量分数 。
Ⅰ、高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:在烧瓶中(装置见图)加入一定量MnO2 和水,搅拌,通入 SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O)。
①石灰乳作用: 。
②若实验中将 换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是
。
换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是
。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿 时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7, 请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤:
[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
① ;
② ;
③检验SO42-是否被洗涤除去; ④用少量乙醇洗涤; ⑤低于100℃干燥。
Ⅱ、锌铝合金的主要成分有Zn、Al、Cu、Si等元素。实验室测定其中Cu含量的步骤如下:①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于250mL容量瓶中。
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,用0.01100mol×L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2 + 2S2O32- = 2I- + S4O62-),消耗Na2S2O3溶液6.45mL。
(1)判断步骤②滴定终点的方法是 。
(2)计算合金中Cu的质量分数 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com