
题目列表(包括答案和解析)
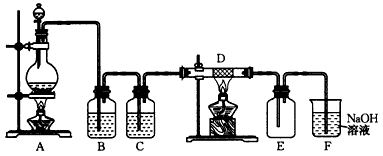
为探究氯气的性质,某同学做了如下图所示的实验,将少量试剂分别放入培养皿中的相应位置,已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.请回答下列问题:

(1)用单线桥表示生成氯气的反应电子转移的方向和数目:
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O(2)实验A的现象是________,反应的离子方程式为________.
(3)实验D的现象是________,反应的离子方程式为________,这一实验说明氧化性Cl2________I2(填“>”或“<”).
(4)实验C的现象是紫色石蕊溶液先变红,后褪色,使石蕊试液变红的反应的离子方程式为________.为了探究褪色原因,这位同学又做了下图所示实验,将干燥的氯气通入双通管中,其中a为干燥的红纸条,b为湿润的红纸条.

①实验现象是:a________,b________.NaOH溶液的作用________.
②该实验说明具有漂白作用的物质是________.
③将氯气通入水中形成黄绿色的氯水,见光放置数天后黄绿色会褪去,同时失去漂白作用,原因是________(用化学方程式表示).
(5)实验B的实验现象是________,工业上利用与实验B类似的反应制备漂白粉,制漂白粉的化学方程式为________.
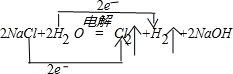
已知制取氯气也可用浓盐酸与高锰酸钾为原料,其化学方程式为
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。请回答下列问题:
(1)用双线桥法标出该化学式电子转移的方向与数目:
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(2)反应中被还原的元素为 (写名称);标准状况下当生成112 L氯气时,反应中转移的电子数目为 。
(3)若有4 molHCl被氧化,则可生成标准状况下的氯气 L。
(4)若有1.58g高锰酸钾和100mL10moL/L浓盐酸充分反应(不考虑盐酸挥发,忽略溶液体积的前后变化),反应至终点时高锰酸钾紫色完全褪去,则被氧化的HCl的物质的量
为 mol。将反应后的溶液取出10mL,加入足量的硝酸银溶液,可得到沉淀的物质的量为 mol。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com