
题目列表(包括答案和解析)
合成氨的流程示意图如下:
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是____________、____________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学方程式________________________,__________________________。
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是________,其中发生的化学反应方程式为__________________________。
(3)设备B的名称为________,其中m和n是两个通水口,入水口是________(填“m”或“n”)。不宜从相反方向通水的原因是________________________________________。
(4)设备C的作用是____________________________________________。
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
已知1 000 K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于________。
| 充电 |
| 放电 |
| ||
| 高温高压 |
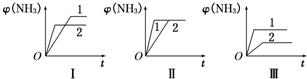
| 时间/min | c(N2)/mol?L-1 | c(H2)/mol?L-1 | c(NH3)/mol?L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
合成氨工业对国民经济和社会发展具有重要的意义。 合成塔中发生反应为: N2(g)+3H2(g)  2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)  CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,
体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K = 。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,
水蒸气的总转化率α (H2O) 。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1 573K(填“>”、“<”或“=”)。
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |

| A.c点表示n(NH3)和n (H2)相等 |
| B.c点表示NH3生成速率与NH3分解速率相同 |
| C.e点和d点时反应的平衡常数相同 |
| D.c点时正反应速率大于逆反应速率 |
 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需(14分)合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
| 达到平衡的时间/min | | 6 | 8 |
| 平衡时 N2的体积密度 | C1 | 1.5 | |
| 混合气体密度/g·L-1 | 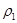 |  | |
| 平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
 d.混合气体的密度保持不变
d.混合气体的密度保持不变 =
=  b.氮气的转化率:
b.氮气的转化率: c.
c. 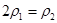 d.
d.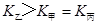
 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com