(2011?江苏)高氯酸按(NH
4ClO
4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
NaClO
4 (aq)+NH
4Cl(aq)
NH
4ClO
4 (aq)+NaCl(aq)
(1)若NH
4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是
氨气与浓盐酸反应放出热量
氨气与浓盐酸反应放出热量
.
(2)反应得到的混合溶液中NH
4ClO
4和NaCl的质量分数分别为0.30和0.15(相关物质的溶解度曲线见图1).从混合溶液中获得较多NH
4ClO
4晶体的实验操作依次为(填操作名称)
蒸发浓缩,冷却结晶,过滤,冰水洗涤
蒸发浓缩,冷却结晶,过滤,冰水洗涤
干燥.
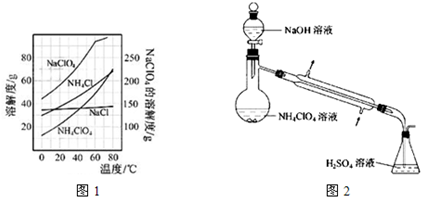
(3)样品中NH
4ClO
4的含量可用蒸馏法进行测定,蒸馏装置如图2所示(加热和仪器固定装代已略去),实验步骤如下:
步骤1:按图2所示组装仪器,检查装置气密性.
步骤2:准确称取样品a g(约 0.5g)于蒸馏烧瓶中,加入约150mL水溶解.
步骤3:准确量取40.00mL约0.1mol?L-?H
2SO
4 溶解于锥形瓶中.
步骤4:经滴液漏斗向蒸馏瓶中加入20mL 3mol?L-?NaOH溶液.
步骤5:加热蒸馏至蒸馏烧瓶中神域约100mL溶液.
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中.
步骤7:向锥形瓶中加入酸碱指示剂,用c mol?L-?NaOH标准溶液滴定至终点,消耗NaOH标准溶液v
1mL
步骤8:将实验步骤1-7重复2次
①步骤3中,准确量取40.00mlH
2SO
4溶液的玻璃仪器是
酸式滴定管
酸式滴定管
.
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是
1,5,6
1,5,6
(填写步骤号).
③为获得样品中NH
4ClO
4的含量,还需补充的实验是
用NaOH标准溶液标定H2SO4溶液的浓度
用NaOH标准溶液标定H2SO4溶液的浓度
.

