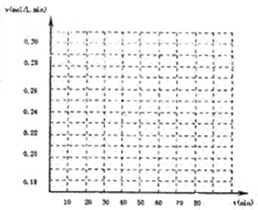
下列说法正确的是__________(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第4min始,混合气体的平均相对分子质量不再变化
D.第6min时,若升高温度,反应平衡常数会减小
E.第8min时,若充入氦气,会导致v正(CO)<v逆(H
2O)
(2) 850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H
2O,1.0 mol CO
2和x mol H
2。若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3)研究小组采用碱液吸收一定量CO
2的方法来提高混合气中H
2与CO
2的体积比。若以1L 1.5mol/L的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO
2,则吸收后溶液中各离子浓度从大到小的顺序是________________。
(4) 如将H
2 与CO
2以4:1的体积比混合,在适当的条件下可制得CH
4。
已知:CH
4(g) + 2O
2(g)

CO
2(g)+ 2H
2O(l) ΔH1=-890.3 kJ/mol
H
2(g) + 1/2O
2(g)

H
2O(l) ΔH2=-285.8 kJ/mol
则CO
2(g)与H
2(g)反应生成CH
4(g)与液态水的热化学方程式是__________________。
(5) 熔融盐燃料电池(见图2)是以熔融碳酸盐为电解质,以CH
4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH
4 +4CO
32--8e
-=5CO
2+2H
2O。正极的电极反应是________。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环,则A物质的化学式是_________。实验过程中,若通入了标准状况下空气448 L(假设空气中O
2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH
4____________L。

 H2(g)+CO2(g) △H=-41.2kJ/mol ,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) △H=-41.2kJ/mol ,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
 CO2(g)+ 2H2O(l) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(l) ΔH1=-890.3 kJ/mol  H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol